Stellungnahme der Kommission für Infektionskrankheiten und Impffragen im Bündnis Kinder- und Jugendgesundheit e.V. (Bündnis KJG)
Federführung: Ulrich von Both & Markus Knuf
Präambel:
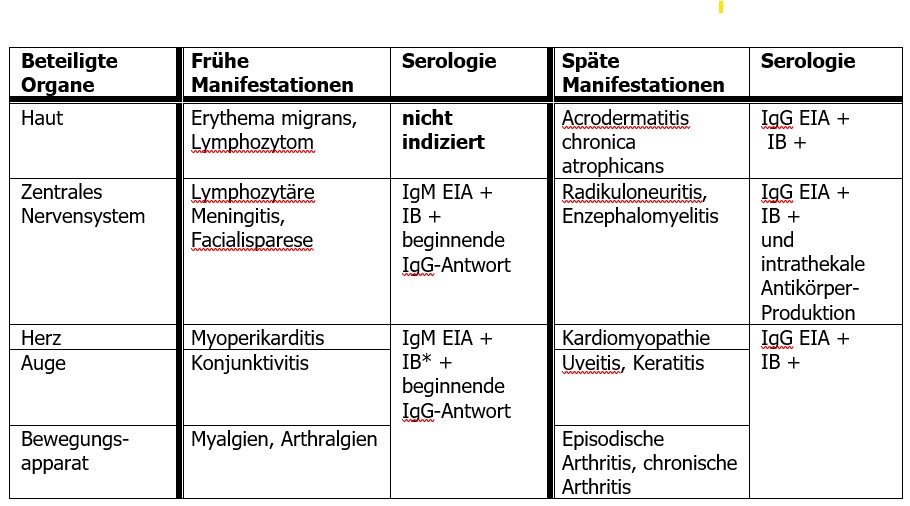
Die Lyme-Borreliose wird durch den Stich einer Zecke, in Europa durch Schildzecken der Art des „Gemeinen Holzbocks“ (Ixodes ricinus), übertragen und durch eine Spirochäten-Infektion des Borrelia burgdorferi sensu lato Komplexes hervorgerufen. Von Borrelia burgdorferi existieren verschiedene Genospezies mit unterschiedlicher geographischer Verteilung und verschiedenem Organtropismus (1–4). Die Lyme-Borreliose präsentiert sich in Deutschland mit einer Reihe von Krankheitsbildern, die bei Kindern und Jugendlichen meist in frühe und späte Manifestationen eingeteilt werden (Tabelle 1). Die Diagnose wird klinisch gestellt oder zumindest vermutet. Laborwerte dienen danach in bestimmten Fällen der Bestätigung des klinischen Verdachtes.
Diese Stellungnahme befasst sich ausschließlich mit den diagnostischen Aspekten der Borreliose. Im Hinblick auf Therapie-Indikation, Auswahl antimikrobieller Substanzen, Dauer der Behandlung und andere relevante Aspekte der Behandlung der Borreliose verweisen wir auf die aktuelle Ausgabe des DGPI Handbuchs (5).
Allgemeine diagnostische Aspekte
Grundsätzlich erfolgt die Entscheidung für eine Borrelien-Diagnostik nur auf Basis einer klinischen Manifestation, die mit einer Lyme-Borreliose vereinbar ist. Zudem gilt, dass bei Vorliegen eines Erythema migrans (EM) oder eines Lymphozytoms keine Labordiagnostik indiziert ist. In allen anderen Fällen folgt die Serodiagnostik der Lyme-Borreliose einem 2-Stufen-Schema, dass zunächst einen Suchtest (Enzym-Immuno-Assay) und dann einen Bestätigungstest (Immunoblot) vorsieht. Zunächst werden also Enzym-Immunoteste eingesetzt, getrennt nach den Immunglobulin-Klassen IgM und IgG. Wegen deren geringer Spezifität wird bei einem positiven oder verdächtigem Ausfall eines Enzym-Immunotestes als Bestätigungstest ein Immunoblot (=Western Blot) durchgeführt (7). Verbesserungen für die Serodiagnostik sind Suchtests (ELISAs), die das vorzugsweise nur in vivo exprimierte Protein VlsE oder die konservierte immundominante C6-Region dieses Proteins enthalten. Bei einer frühen Lyme-Borreliose finden sich borrelienspezifische IgM-Antikörper ab der 3. Woche und IgG-Antikörper ab der 6. Woche nach Infektion (8). Durch Vergleich der Antikörper-Konzentrationen in Serum und Liquor (Serum-Liquor Korrelation) kann über eine Schrankenstörung hinaus die intrathekale Antikörper-Produktion nachgewiesen werden. Die beschriebenen diagnostischen Strategien sind seit über 10 Jahren festgelegt und der wissenschaftliche Fortschritt ist seitdem gering. Trotz guter Darlegungen im Schrifttum wie im Handbuch der DGPI (5) bereitet die Diagnosestellung der Lyme-Borreliose immer wieder Probleme, sodass diese hier praxisnah dargestellt werden soll.
Überblick über klinische Manifestationen, soweit diese für die Diagnostik von Bedeutung sind
Die mit Abstand häufigste Form der Lyme-Borreliose ist das Erythema migrans (EM), bei dem eine Labordiagnostik nicht indiziert ist. Weitere dermatologische Manifestationen sind das Borrelien-Lymphozytom (auch hier ist keine Labordiagnostik indiziert) und die Akrodermatitis chronica atrophicans (Spätmanifestation). Zu nennen sind auch die Lyme-Arthritis sowie die Lyme-Karditis (2, 6, 4). Bei den Manifestationen des Nervensystems (Neuroborreliose) unterscheidet man Früh- und Spätformen. Frühmanifestationen treten wenige Wochen nach einer Infektion auf (ca. 98% der Neuroborreliose-Fälle).
Zu nennen sind hier
• Hirnnervenlähmungen, insbesondere des N. facialis, fast immer mit
• aseptischer Meningitis
• Bannwarth-Syndrom (Polyradikuloneuritis)
Eine Hirnnervenbeteiligung findet sich bei ca. 2/3 der Patienten, die oftmals auch als alleinige Manifestation vorliegen kann und am häufigsten (80%) den N. facialis betrifft. Bei Kindern ist die Meningitis die vorherrschende Manifestationsform einer Neuroborreliose. Die typischen Symptome beinhalten Kopfschmerzen, Übelkeit und Meningismus, können aber sehr diskret ausgeprägt sein. Eine Polyradikuloneuritis spinaler und/oder kranialer Nerven ist die häufigste Frühmanifestation der Neuroborreliose im Erwachsenenalter (9, 10). Spätmanifestationen treten schleichend über Monate bis Jahre nach einer Infektion in ca. 2% der Neuroborreliose-Fälle auf.
Hierzu gehören:
• Enzephalomyelitis mit spastisch-ataktischem Gangbild und Miktionsstörungen
• Borrelien-induzierte zerebrale Vaskulitis. Insbesondere das vertebrobasiläre Stromgebiet ist hier betroffen. Die Manifestation fällt mit zerebralen Ischämien auf.
• Neuritis peripherer Nerven/Polyneuropathie: In Europa tritt diese Manifestationsform wahrscheinlich nur im Rahmen einer Akrodermatitis chronica atrophicans auf (11, 12).
Da eine späte Neuroborreliose im Kindesalter selten ist, wird in dieser Stellungnahme nicht näher darauf eingegangen und diesbezüglich auf des aktuelle DGPI Handbuch verwiesen bzw. auf Zentren, die über entsprechende Erfahrung damit verfügen.
Bei der Neuroborreliose werden drei Falldefinitionen in Abschnitt 3.10 der aktuellen S3-Leitlinie ‚Neuroborreliose‘ vorgeschlagen, im Folgenden zitiert (13, 14):
Mögliche Neuroborreliose:
• typisches klinisches Bild (Hirnnervenausfälle, Meningitis/Meningoradikulitis, fokale neurologische Ausfälle).
• Borrelien-spezifische IgG- und/oder IgM-Antikörper im Serum (kann In sehr frühen Krankheitsstadien [noch] negativ sein)
• Liquorbefund nicht vorliegend/Liquorpunktion nicht durchgeführt
• Abgrenzung anderer Ursachen
Wahrscheinliche Neuroborreliose:
• Wie „mögliche Neuroborreliose“, jedoch zusätzlich
• entzündliches Liquorsyndrom mit lymphozytärer Pleozytose, Blut-Liquor-Schrankenstörung und intrathekaler Immunglobulinsynthese.
Gesicherte Neuroborreliose:
• Wie „wahrscheinliche Neuroborreliose“, aber zusätzlich
• intrathekale Synthese Borrelien-spezifischer Antikörper (positiver IgG- und/oder IgM-Antikörper-Index) im Liquor oder [ positiver kultureller oder
• Nukleinsäurenachweis (PCR) im Liquor
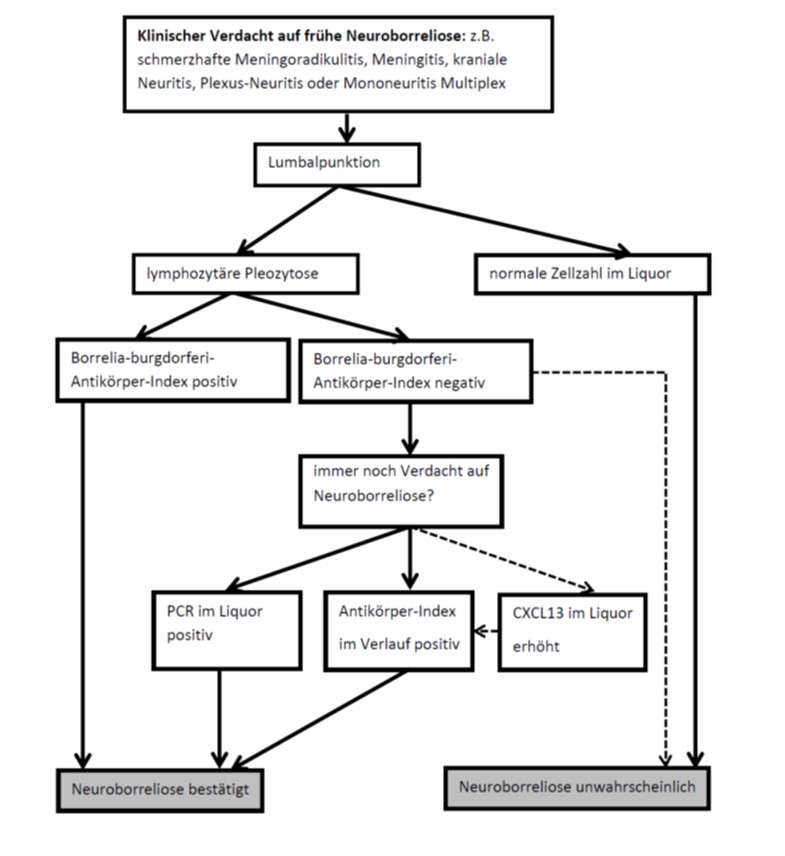
Verdacht auf frühe Neuroborreliose
(Symptomdauer Wochen bis Monate (15–17))
Diese Form macht vermutlich über 98% der Fälle (18, 19) einer Neuroborreliose aus. Dabei tritt die neurologische Symptomatik wenige Wochen bis einige Monate nach dem Zeckenstich auf.
Die aseptische Meningitis (selten begleitet von einer radikulären Symptomatik) wird in Europa überwiegend bei Kindern beobachtet (15, 18, 20–22). Bei Hirnnervenlähmung, besonders Fazialisparese, und/oder Zeichen der Meningitis mit Kopfschmerzen, Antriebslosigkeit und meist sehr diskreter Nackensteifheit sollte auch eine Lyme-Borreliose in Erwägung gezogen werden. Besonders bei Fehlen der Hirnnervenlähmung wird die mögliche Diagnose Neuroborreliose nicht oft genug bedacht. Falls außer Kopfschmerzen keine weiteren Befunde zu erheben sind, findet sich im Gegensatz zu anderen Ursachen der Kopfschmerzen ein meist klar anzugebender Beginn sowie eine kurze Dauer der Symptomatik.
Weitere eher seltene Manifestation, v.a. ab dem Jugendalter, umfassen zudem eine schmerzhafte Meningopolyradikulitis spinaler Nerven in Verbindung mit einer einseitigen oder ggf. auch beidseitigen Fazialisparese (Bannwarth-Syndrom). Beim Bannwarth-Syndrom findet man in etwa 60% der Fälle Hirnnervenausfälle. Die Symptome der Radikulitis entwickeln sich im Mittel 4–6 Wochen (maximal 1–18 Wo) nach dem Zeckenstich bzw. nach dem EM (15, 23).
Diagnostik:
Prinzipien & Verfahren der Labordiagnostik
Bei der Labordiagnostik unterscheidet man indirekte und direkte und Nachweistechniken:
I) Indirekter Erregernachweis mittels serologischer Diagnostik von Borrelien:
1. Enzymimmunoassay (EIA oder ELISA)
2. Immunoblot (IB), auch als „Western Blot“ bezeichnet.
3. Indirekter Immunfluoreszenztest (IIFT; nur noch selten verwendet)
Besonderheiten bei der Interpretation von serologischen Ergebnissen im Rahmen der Borrelien-Diagnostik (8)
Fehlende IgM-Antikörper schließen eine akute Infektion nicht aus. Auch aus diesem Grund ist beim EM und Lymphzytom keine Labordiagnostik indiziert.
• Nach akuter, sachgerecht behandelter Borreliose können IgM-Antikörper weiterhin über viele Monate und ggf. auch Jahre persistieren. Deshalb sind serologische Verlaufskontrollen nicht sinnvoll. Eine serologische Kontrolle nach erfolgter antiinfektiver Therapie lässt keine Aussage über den Therapieerfolg zu.
• Eine serologische Diagnostik einer Borrelien Infektion ist nur bei passender Klinik indiziert. Entsprechend stellt der Nachweis von IgM-Antikörpern ohne klinische Symptome keine Indikation für eine Therapie dar. Nur bei genauer Kenntnis der klinischen Manifestation kann eine Wiederholung der Serologie im Abstand von 3 oder 4 Wochen sinnvoll sein. Entsprechend sollten nur die behandelnden Kinder- und Jugendärztinnen und -ärzte über die Notwendigkeit einer zweiten serologischen Untersuchung entscheiden.
• Bei einer späten Lyme-Borreliose fehlen IgM-Antikörper häufig. Es kann jedoch zu einer unspezifischen Reaktion im IgM-Blot kommen (viele Banden); eine Kreuzreaktion mit Rheumafaktoren ist möglich.
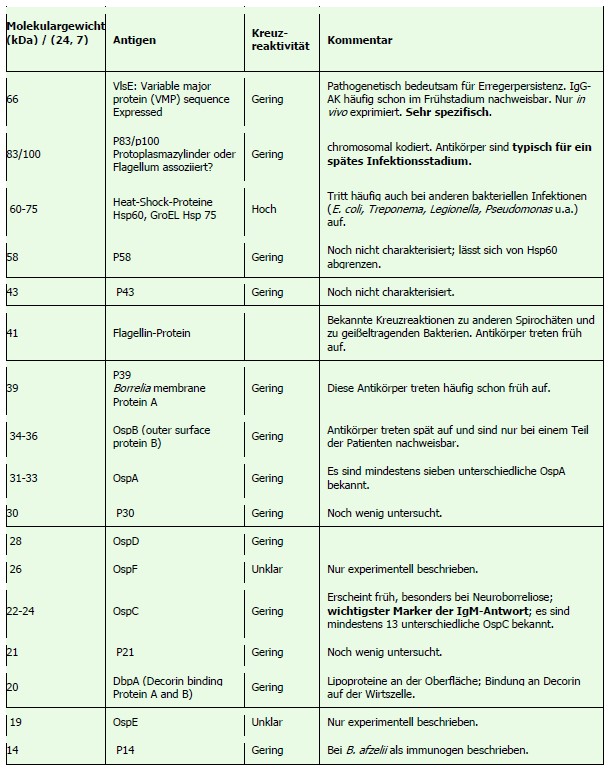
• Für die Beurteilung der Borrelien-Serologie ist die Höhe der Antikörper im EIA bzw. die Anzahl der spezifischen Banden sowie die Art der Banden zu berücksichtigen (Tab 2).
Im Rahmen der Borrelien-Diagnostik sind eine Vielzahl von Antigenen nachweisbar. Diese stammen von unterschiedlichen Borrelien-Stämmen, in Europa vorwiegend von Borrelia afzelii und Borrelia garinii. Neben den Tests, die auf Lysatantigen basieren, werden seit etlichen Jahren Testsysteme mit rekombinantem Antigen vorgehalten. Ein bekanntes Borrelien-Protein ist das Oberflächenprotein Outer-surface-protein (Osp), von dem es mehrere Vertreter gibt. Der Vorteil von rekombinanten Antigenen ist, dass kreuzreagierende Antigene eliminiert werden können. Auch können unterschiedliche, für eine IgM-Testung spezifizierte „Mischungen“ erstellt werden. Neben der bekannten rekombinant bzw. aus der Kultur abgeleiteten Antigen-Diagnostik stehen weitere Borrelien-Antigene zur Verfügung, die lediglich in vivo exprimiert werden (8).
Tabelle 2 gibt die Nomenklatur der Borrelien-Antigene und ihre Bedeutung für die Diagnostik wieder (Abb. modifiziert nach Enders et al. (7, 24))
II) Direkter Erregernachweis:
1. Hierunter versteht man die Anzucht von Borrelien aus einem Isolat. In den vergangenen Jahren wurde weiter an einer Verbesserung der kulturellen Diagnostik gearbeitet. Das Verfahren dauert jedoch weiterhin sehr lange (bis zu 12 Wochen), hat eine geringe Sensitivität und ist spezialisierten Laboren vorbehalten. Die Kultur aus Liquorproben ist äußerst selten positive und wird nicht empfohlen (7, 25).
2. Nukleinsäureamplifikationstechniken (NAT), z. B. mittel Polymerase-Kettenreaktion (PCR): Die Methode ist etabliert und führt schnell zu einem Ergebnis. Auch dieses Verfahren bleibt derzeit spezialisierten Laboren vorbehalten (26). Während die PCR hochspezifisch ist, hängt die Sensitivität vom Untersuchungsmaterial ab. In Patienten mit Lyme Arthritis hat eine PCR aus der Synovialflüssigkeit eine Sensitivität von 46% bis 96% (27). Ein PCR aus einer Liquorprobe von Patienten mit neurologischen Manifestationen der Lyme Erkrankung hat hingegen eine Sensitivität von lediglich 20% bis 40% (28, 29).
In der Frühphase der Lyme-Borreliose werden, jedoch nicht in allen Fällen, IgM-Antikörper gebildet (8). Diese sind vor allem gegen OspC gerichtet. In Abhängigkeit vom Testverfahren werden auch p41-Antikörper gefunden, die jedoch nicht so spezifisch sind wie jene gegen OspC. Weitere Banden sind gegen BmpA und Osp17 gerichtet. IgM-Antikörper sind drei bis sechs Wochen nach dem Zeckenstich zu erwarten. Anders als bei anderen Infektionskrankheiten beginnt die IgG-Antikörperbildung in der Regel deutlich später. Allerdings ist VlsE-IgG häufig schon zeitgleich mit IgM-Antikörpern nachweisbar. Da in der akuten Neuroborreliose Antikörper zunächst nur im Liquor nachweisbar sein können, kann bei eindeutiger Klinik und negativer Serologie eine Liquor-Untersuchung sinnvoll sein.
Im Verlauf, also bei Übergang von der frühen in die späte Phase der Lyme-Borreliose, werden zunehmend auch IgG-Antikörper gegen weitere Antigene gebildet. In der Spätphase sind IgG-Antikörper in aller Regel deutlich positiv nachweisbar. IgM-Antikörper können hierbei weiterhin persistieren. Nach einer erfolgreichen Therapie fallen IgG- (und IgM-) Antikörper nur langsam ab.
Die Liquor-Untersuchung hat bei klinischem Verdacht auf eine Neuroborreliose neben spezifischen Antikörper-Untersuchungen die größte diagnostische Bedeutung. Folgende Befunde beweisen eine Lyme-Borreliose: Lymphozytäre Liquorpleozytose, Blut/Liquor-Schrankenstörung und autochthone Synthese von Immunglobulin (positiver ASI), vornehmlich der Klassen IgM und IgA. Obwohl nur ein Teil der Kinder mit einer Fazialisparese infolge einer Lyme-Borreliose Meningitiszeichen aufweist, sind hier meist entzündliche Liquorveränderungen nachweisbar.
Der Nachweis des neuronalen, B-Zell-induzierenden Chemokins CXCL13 im Liquor ist ein relativ neuer und noch nicht allgemein akzeptierter möglicher Biomarker für eine aktive Neuroborreliose. In den vergangenen Jahren wurde gezeigt, dass CXCL13 bei nahezu allen Patienten mit akuter Neuroborreliose im Liquor schon nachweisbar ist, während die spezifische Antikörperantwort noch negativ ist. Also insbesondere in der frühen Phase der Borreliose ist die CXCL13-Konzentration im Liquor deutlich erhöht (30). Der Parameter ist hilfreich, da sich damit eine diagnostische Lücke schließen lässt.
CXCL13 ist allerdings nicht spezifisch für eine Neuroborreliose. Auch bei anderen neurologischen (Infektions-) Erkrankungen ist es nachweisbar. So wurden erhöhte Liquor-Werte auch bei Neurolues, tuberkulöser Meningitis und ZNS-Lymphomen gefunden (31–37). Zudem ist die CXCL13 Bestimmung bisher noch nicht standardisiert und auf ausgewählte Labore beschränkt.
CAVE: Folgende Verfahren gelten als ungeeignet für den Nachweis einer (Neuro)borreliose (8)
• Immunoblot als Suchtest bei negativen ELISA-Befund,
• Antigennachweis in Körperflüssigkeiten
• Phagennachweis
• PCR aus Serum oder Urin
• Lymphozyten-Transformations- oder Aktivierungsteste (u.a. LTT, ELISPOT)
• Lichtmikroskopischer immunhistochemischer Direktnachweis aus Patientenmaterial
• HLA-Typisierung, Untersuchung auf CD57pos/CD3neg Lymphozyten-Populationen
• Untersuchung von Zecken auf Borrelien zum Stellen einer Therapieindikation
Abbildung 1 gibt einen diagnostischen Algorithmus bei Verdacht auf frühe Neuroborreliose wieder. Anders als bei der Liquor- und Antikörperdiagnostik haben Kultur und Anzucht aus dem Liquor sowie die PCR eine unzureichende Sensitivität (10-13%).
Vorgehen bei Verdacht auf weitere Manifestationen einer Lyme-Borreliose
Es gibt eine Reihe weiterer, seltener Manifestationen der Borreliose: wenn der begründete klinische Verdacht besteht, wird die Diagnose im Allgemeinen ebenfalls mittels Serologie bestätigt. Dazu gehören die Augenbeteiligung mit Keratitis, Iridozyklitis oder Uveitis intermedia; die Herzbeteiligung mit AV-Block; und die späte Hauterkrankung in Form der Acrodermatitis chronica atrophicans. Hingegen ist beim Borrelien-Lymphozytom, meist an Ohrläppchen, Mamille oder Scrotum lokalisiert, die Serologie manchmal falsch negativ, so dass hier ebenfalls wie beim EM eine klinische Diagnose zu stellen ist.
Empfehlungen bei unspezifischer Symptomatik
Manchmal wird bei funktionellen Problemen und Befindlichkeitsstörungen der Verdacht auf eine „Borreliose“ geäußert. Meist aber lässt sich diese unspezifische Symptomatik nicht einer der bekannten Manifestationen der Lyme-Borreliose zuordnen.
Bei chronischen Kopfschmerzen oder „Leistungsknick“ kann der Beginn meist nicht genau angegeben werden, was gegen eine Neuroborreliose spricht. Besteht dennoch der Verdacht auf eine Neuroborreliose, muss begleitend zur Serum-AK Bestimmung auch eine Lumbalpunktion durchgeführt werden. Ein unauffälliger Liquor-Befund macht eine Neuroborreliose sehr unwahrscheinlich. Bei Beschwerden am Bewegungsapparat wird gelegentlich eine Lyme-Arthritis vermutet, obwohl die Arthritis fehlt. In all diesen Fällen ist eine Borrelien-Serologie nicht indiziert.
Kritische Anmerkungen zur Diagnostik und der Interpretation von serologischen Ergebnissen
Wie dargelegt können die Diagnostik der Lyme-Borreliose und die Interpretation der Serologie auf Borrelia burgdorferi schwierig sein. Deshalb wird manchmal von Labormedizinern empfohlen, nach einigen Wochen oder Monaten die Borrelien-Serologie erneut durchzuführen. Dies führt aber nur selten zu neuen Aufschlüssen. Deshalb sollte nur in begründeten Ausnahmen die Serologie nach einem Intervall wiederholt werden. Nicht selten enthält die vom Labormediziner interpretierte Serologie auch Therapie-Empfehlungen. Dazu ist jedoch die genaue Kenntnis von Klinik und bisherigen therapeutischen Maßnahmen notwendig, sodass eine solche Empfehlung oft inakkurat oder ggf. sogar falsch ist. Zudem sind zwei weitere diagnostische Strategien empfohlen worden: die Untersuchung einer von der Haut eines Menschen entfernten Zecke auf Borrelien und die Untersuchung der Lymphozyten des peripheren Blutes auf ihre Fähigkeit, nach Zugabe von Borrelien-Antigenen zu proliferieren. Beide Strategien sind nicht geeignet, um eine Lyme Borreliose zu diagnostizieren. Der PCR-Borrelien Nachweis in einer Zecke sagt nichts darüber aus, ob eine Infektion tatsächlich stattgefunden hat. Der Lymphozyten-Transformations- oder Aktivierungstest ist ein in vitro-Verfahren und nicht standardisiert. Valide Aussagen zur klinischen Bedeutung des Testverfahrens fehlen, so dass diese Methode nicht empfohlen wird.
Fazit zur klinisch gesteuerten rationalen Borreliose Diagnostik
Die Frühform Erythema migrans sowie Lymphozytom wird klinisch diagnostiziert und bedarf keiner Labordiagnostik. Grundsätzlich erfolgt die Entscheidung für eine Borrelien-Diagnostik nur auf Basis einer klinischen Manifestation, die mit einer Lyme-Borreliose vereinbar ist.
Bei V. a. Neuroborreliose erfolgt ein gestuftes Abklärungsverfahren: In einem ersten Schritt erfolgt die Labordiagnostik mittels Nachweises spezifischer IgG- und IgM-Antikörper gegen Borrelia burgdorferi im Blut und Liquor. Als Suchtest wird ein ELISA eingesetzt. Ein positives Ergebnis wird durch den Bestätigungs-test „Immunoblot“ verifiziert. Für die Diagnose einer gesicherten Neuroborreliose werden Borrelien-spezifische Antikörper im Liquor gefordert (ASI für IgG oder IgM). Nachteilig ist die geringe Sensitivität für den Liquorantikörpernachweis im frühen Stadium der Neuroborreliose bei Kindern (38). Ferner gelingt der spezifische Antikörpernachweis häufig nur im Serum und nicht im Liquor. Die Befundinterpretation wird durch die Tatsache erschwert, dass für Antikörper gegen Borrelia burgdorferi eine mit dem Alter zunehmendem hohe Seroprävalenz vorliegt (39).
Generell kann in Bezug auf die Neuroborreliose (des Erwachsenenalters) auf die Empfehlungen der aktuellen S3K Leitlinie der Deutschen Gesellschaft für Neurologie verwiesen werden. Dabei ist jedoch zu bedenken, dass es nach Konsentierung der aktuellen Fassung einige kritische Bewertungen zu Teilaspekten der Leitlinie gab. Dies verdeutlicht, dass es weiterhin offene Fragen gibt. Auch diese Stellungnahmen der Kommission stellt in diesem Sinne eine aktuelle Momentaufnahme dar, die in Zukunft wieder überarbeitet bzw. ergänzt werden wird.
Stellungnahme der Kommission
Aus den obigen Ausführungen ergeben sich folgende Empfehlungen:
1. Die Kommission fordert die Kinder- und Jugendärztinnen und -ärzte auf, nur dann eine serologische Untersuchung oder ggf. Erreger-Direktnachweise auf Borrelien anzufordern, wenn dazu ein begründeter klinischer Verdacht besteht. Bei chronischen Schmerzen oder Befindlichkeitsstörungen ohne spezifische klinische Hinweise besteht dieser Verdacht nicht.
2. Unbegründete und nicht validierte Tests tragen aus Sicht der Kommission nicht zur Klärung der Diagnose bei und sollten deshalb grundsätzlich unterlassen werden. Zu diesen Untersuchungen gehören serologische Teste ohne begründeten klinischen Verdacht, Teste auf borreliale Antigene oder DNA-Sequenzen in Zecken sowie Lymphozyten-Transformationsteste.
3. Generell sind serologische Kontrollen im Langzeitverlauf nicht angezeigt. Sie sind nur begründet, wenn die Initialdiagnostik sehr früh durchgeführt wurde, eine Diagnose nicht hinreichend klarzustellen war und die typischen klinischen Symptome weiterhin an eine Lyme-Borreliose denken lassen. Meist bringt die Wiederholung der Serologie jedoch keinen weiteren Aufschluss. Entsprechend sollten nur die behandelnden Kinder- und Jugendärztinnen und -ärzte in genauer Kenntnis der klinischen Manifestation über eine Wiederholung der Serologie im Abstand von 3 oder 4 Wochen entscheiden.
4. Labormediziner sollten bei der Wertung der gefundenen Ergebnisse auf therapeutische Empfehlungen verzichten und auch keine Empfehlung zu Verlaufskontrollen oder Therapieindikation aussprechen. Nur die betreuenden Kinder- und Jugendärztinnen und -ärzte sind in Kenntnis der klinischen Manifestationen und eventuell vorausgegangener therapeutischer Maßnahmen dazu befähigt, die Befunde entsprechend zu interpretieren.
Stellungnahme der Kommission für Infektionskrankheiten und Impffragen des Bündnis Kinder- und Jugendgesundheit e. V.:
Mitglieder: PD Dr. med. Ulrich von Both (München, federführend), Dr. med. H. Grundhewer (Berlin), Prof. Dr. med. U. Heininger (Basel, Kommissionssprecher), Prof. Dr. med. H.-I. Huppertz (Bremen), Dr. med. A. Iseke (Münster), Prof. Dr. med. M. Knuf (Wiesbaden, federführend), Prof. Dr. med. G. Ch. Korenke (Oldenburg), Prof. Dr. med. A. Müller (Bonn)
Korrespondenzadresse:
Bündnis Kinder- und Jugendgesundheit e.V.
Chausseestr. 128/129, 10115 Berlin
Tel.: 030.4000588-0, Fax.: 030.4000588-88
e-Mail: kontakt@buendnis-kjg.de, Internet: www.buendnis-kjg.de
Literatur
1. Böhme M, Schembra J, Bocklage H, Schwenecke S, Fuchs E, Karch H et al. Infektionen mit Borrelia burgdorferi bei Würzburger Blutspendern: Antikörperprävalenz, Klinik und Erregernachweis bei antikörperpositiven Spendern. Beitr Infusionsther 1992; 30:96–9.
2. Dressler F, Yoshinari NH, Steere AC. The T-cell proliferative assay in the diagnosis of Lyme disease. Ann Intern Med 1991; 115(7):533–9.
3. Hayes EB, Piesman J. How can we prevent Lyme disease? N Engl J Med 2003; 348(24):2424–30.
4. Nadelman RB, Wormser GP. Lyme borreliosis. The Lancet 1998; 352(9127):557–65.
5. Bialek R, Borte M, Forster J. DGPI Handbuch: Infektionen bei Kindern und Jugendlichen. 7. vollständig überarbeitete Auflage. Stuttgart: Thieme; 2018. Available from: URL: http://nbn-resolving.org/urn:nbn:de:bsz:24-epflicht-1930549.
6. Huppertz HI. Childhood Lyme borreliosis in Europe. Eur J Pediatr 1990; 149(12):814–21.
7. Kobayashi T, Auwaerter PG. Diagnostic Testing for Lyme Disease. Infect Dis Clin North Am 2022; 36(3):605–20.
8. Fingerle V, Sing A. Diagnose und Therapie der Lyme-Borreliose – alles unklar, alles schlecht? Kinder- und Jugendmedizin 2022; 22(03):158–64.
9. Guy N. Maladie de Lyme: bases fondamentales à l’origine des mesures préventives, mesures de prévention primaire et secondaire. Med Mal Infect 2007; 37(7-8):381–93.
10. Pfister H-W, Einhäupl KM, Wilske B, Preac-Mursic V. Bannwarth’s syndrome and the enlarged neurological spectrum of arthropod-borne borreliosis. Zentralblatt für Bakteriologie, Mikrobiologie und Hygiene. Series A: Medical Microbiology, Infectious Diseases, Virology, Parasitology 1987; 263(3):343–7.
11. Handbuch der Deutschen Gesellschaft für Pädiatrische Infektiologie.
12. Mygland A, Skarpaas T, Ljøstad U. Chronic polyneuropathy and Lyme disease. Eur J Neurol 2006; 13(11):1213–5.
13. Rauer Sebastian, Kastenbauer Stephan. Neuroborreliose, S3-Leitlinie; 2018 [cited 2022 Jun 12]. Available from: URL: https://dgn.org/wp-content/uploads/2013/01/030071_LL_Neuroborreliose_2018.pdf.
14. Heininger U, Zimmermann T, Schoerner C, Brade V, Stehr K. Zeckenstich und Lyme-Borreliose. Eine epidemiologische Untersuchung im Raum Erlangen. Monatsschr Kinderheilkd 1993; 141(11):874–7.
15. Hansen K, Lebech AM. The clinical and epidemiological profile of Lyme neuroborreliosis in Denmark 1985-1990. A prospective study of 187 patients with Borrelia burgdorferi specific intrathecal antibody production. Brain 1992; 115 (Pt 2):399–423.
16. Oschmann P, Dorndorf W, Hornig C, Schäfer C, Wellensiek HJ, Pflughaupt KW. Stages and syndromes of neuroborreliosis. J Neurol 1998; 245(5):262–72.
17. Kaiser R. Variable CSF findings in early and late Lyme neuroborreliosis: a follow-up study in 47 patients. J Neurol 1994; 242(1):26–36.
18. Koedel U, Fingerle V, Pfister H-W. Lyme neuroborreliosis-epidemiology, diagnosis and management. Nat Rev Neurol 2015; 11(8):446–56.
19. Huppertz HI, Böhme M, Standaert SM, Karch H, Plotkin SA. Incidence of Lyme borreliosis in the Würzburg region of Germany. Eur J Clin Microbiol Infect Dis 1999; 18(10):697–703.
20. Berglund J, Eitrem R, Ornstein K, Lindberg A, Ringér A, Elmrud H et al. An epidemiologic study of Lyme disease in southern Sweden. N Engl J Med 1995; 333(20):1319–27.
21. Christen HJ. Lyme neuroborreliosis in children. Ann Med 1996; 28(3):235–40.
22. Pfister H-W, Wilske B, Weber K. Lyme borreliosis: basic science and clinical aspects. The Lancet 1994; 343(8904):1013–6.
23. Reik L, Steere AC, Bartenhagen NH, Shope RE, Malawista SE. Neurologic abnormalities of Lyme disease. Medicine (Baltimore) 1979; 58(4):281–94.
24. Tewald Friedemann. Labordiagnostik der Borreliose; 2019 [cited 2022 Aug 26]. Available from: URL: https://www.labor-enders.de/2019/09/18/labordiagnostik-der-borreliose/.
25. Sapi E, Pabbati N, Datar A, Davies EM, Rattelle A, Kuo BA. Improved culture conditions for the growth and detection of Borrelia from human serum. Int J Med Sci 2013; 10(4):362–76.
26. Branda JA, Lemieux JE, Blair L, Ahmed AA, Hong DK, Bercovici S et al. Detection of Borrelia burgdorferi Cell-free DNA in Human Plasma Samples for Improved Diagnosis of Early Lyme Borreliosis. Clin Infect Dis 2021; 73(7):e2355-e2361.
27. Li X, McHugh GA, Damle N, Sikand VK, Glickstein L, Steere AC. Burden and viability of Borrelia burgdorferi in skin and joints of patients with erythema migrans or lyme arthritis. Arthritis Rheum 2011; 63(8):2238–47.
28. Cerar T, Ogrinc K, Cimperman J, Lotric-Furlan S, Strle F, Ruzić-Sabljić E. Validation of cultivation and PCR methods for diagnosis of Lyme neuroborreliosis. J Clin Microbiol 2008; 46(10):3375–9.
29. Nocton JJ, Bloom BJ, Rutledge BJ, Persing DH, Logigian EL, Schmid CH et al. Detection of Borrelia burgdorferi DNA by polymerase chain reaction in cerebrospinal fluid in Lyme neuroborreliosis. J Infect Dis 1996; 174(3):623–7.
30. Rupprecht TA, Manz KM, Fingerle V, Lechner C, Klein M, Pfirrmann M et al. Diagnostic value of cerebrospinal fluid CXCL13 for acute Lyme neuroborreliosis. A systematic review and meta-analysis. Clin Microbiol Infect 2018; 24(12):1234–40.
31. Dersch R, Freitag MH, Schmidt S, Sommer H, Rauer S, Meerpohl JJ. Efficacy and safety of pharmacological treatments for acute Lyme neuroborreliosis – a systematic review. Eur J Neurol 2015; 22(9):1249–59.
32. Dersch R, Sommer H, Rauer S, Meerpohl JJ. Prevalence and spectrum of residual symptoms in Lyme neuroborreliosis after pharmacological treatment: a systematic review. J Neurol 2016; 263(1):17–24.
33. Dersch R, Toews I, Sommer H, Rauer S, Meerpohl JJ. Methodological quality of guidelines for management of Lyme neuroborreliosis. BMC Neurol 2015; 15:242.
34. Hytönen J, Kortela E, Waris M, Puustinen J, Salo J, Oksi J. CXCL13 and neopterin concentrations in cerebrospinal fluid of patients with Lyme neuroborreliosis and other diseases that cause neuroinflammation. J Neuroinflammation 2014; 11:103.
35. Rubenstein JL, Wong VS, Kadoch C, Gao H-X, Barajas R, Chen L et al. CXCL13 plus interleukin 10 is highly specific for the diagnosis of CNS lymphoma. Blood 2013; 121(23):4740–8.
36. Rupprecht TA, Plate A, Adam M, Wick M, Kastenbauer S, Schmidt C et al. The chemokine CXCL13 is a key regulator of B cell recruitment to the cerebrospinal fluid in acute Lyme neuroborreliosis. J Neuroinflammation 2009; 6:42.
37. Schmidt C, Plate A, Angele B, Pfister H-W, Wick M, Koedel U et al. A prospective study on the role of CXCL13 in Lyme neuroborreliosis. Neurology 2011; 76(12):1051–8.
38. Tveitnes D, Øymar K, Natås O. Laboratory data in children with Lyme neuroborreliosis, relation to clinical presentation and duration of symptoms. Scand J Infect Dis 2009; 41(5):355–62.
39. Robert Koch-Institut. RKI-Ratgeber Lyme-Borreliose 2019.


