Stellungnahme der Kommission für Infektionskrankheiten und Impffragen des Bündnisses Kinder- und Jugendgesundheit e.V. und der Gesellschaft für
Pädiatrische Pneumologie
Stand 23. September 2025
Federführung: Ulrich von Both (Kommission) & Markus Rose (Gesellschaft für Pädiatrische
Pneumologie, GPP)
1. Präambel
Husten ist ein natürlicher Schutz- und Reinigungsmechanismus der Atemwege. Ein hustendes Kind ist der häufigste Grund für die Inanspruchnahme medizinischer Grundversorgung [Britt 2016] und Husten beeinträchtigt die Lebensqualität der Betroffenen wie auch ihrer Familien [Newcombe 2016]. Ein gesundes Kind kann zwischen 1 und 34 mal in 24 Stunden husten [Munyard & Bush 1996]. Pathophysiologisch kommt es durch Infektionen, chemische oder physikalische Reize, Schleim, Entzündung, Fremdkörper oder Stress zur Aktivierung von Hustenrezeptoren, Glottisverschluss, intrathorakalem Druckaufbau und explosionsartigem Herauspressen der Luft aus den wieder geöffneten Atemwegen. Prolongiertes Auftreten von feuchtem Husten im Kindesalter führt häufig zur Frage nach einer antibiotischen Therapie durch die Betroffenen bzw. deren Familien. Die Empfehlungen zur rationalen Antibiotikatherapie („Antibiotic Stewardship“) sind mittlerweile gängige Praxis und fordern einen restriktiven Einsatz dieser Substanzen. Diese sollen bei pädiatrischen – meist viral bedingten – respiratorischen Beschwerden nicht primär zum Einsatz kommen; im Falle eines Einsatzes soll dieser fünf (max. sieben) Tage nicht überschreiten (CAP Leitlinie 2024, AWMF). Andererseits kann bei chronischfeuchtem Husten bakterieller Genese diese Therapiedauer zu kurz sein und einen Therapieerfolg verhindern. Die nachfolgende Stellungnahme adressiert das diagnostische und therapeutische Vorgehen bei diesem wichtigen pädiatrischen Krankheitsbild, insbesondere der protrahierten bakteriellen Bronchitis (PBB).
2. Definitionen und Epidemiologie
Im Anschluss an virale Luftwegsinfektionen husten Kinder typischerweise noch zwei bis drei Wochen, teils auch länger [Thompson 2013). In einer australischen Kohortenstudie an 839 Kindern hustete jedes fünfte Kind nach einer respiratorischen Infektion noch nach 28 Tagen [O’Grady 2017]. Internationale Fachgesellschaften sprechen von chronischem Husten bei Kindern und Jugendlichen, wenn dieser mindestens vier Wochen (American College of Chest Physicians (ACCP), Thoracic Society of Australia and New Zealand (TSANZ) [Chang Chest 2006; Chang Med J Austr 2006] bzw. mindesten acht Wochen dauert (British Thoracic Society (BTS); [Shields 2007].
3. Ätiopathogenese
Die Ursachen chronischen Hustens bei Kindern und Jugendlichen sind vom Lebensalter und der Lebenssituation abhängig und können auch in den oberen Atemwegen zu finden sein.
Exposition gegenüber eingeatmeten Irritantien, z.B. Tabakrauch, Abgase, organische und anorganische Stäube oder Aeroallergene können chronischen Husten verursachen und unterhalten (Morice et al ERS 2020). Beim Husten-Syndrom der oberen Atemwege (HSOA) bestehen häufig eine allergische Rhinitis, adenoide Vegetationen, Sinusitiden oder Fehlbildungen der oberen Atemwege.
Asthmatischer Husten geht klassischerweise mit anfallsartigem Giemen und Atemnot einher, kann sich aber auch oligosymptomatisch durch zähen Schleim („Räusper-Asthma“) oder reinen Husten äußern („Husten-Varianten Asthma“) (Doan 1992).
Diagnostisch wegweisend ist bei Kindern jeglichen Alters die klinische Verbesserung bei Anwendung eines systemischen Kortikosteroids nach einigen Tagen bis maximal zwei Wochen (Doan 1992; Weinberger 2012; Pavord 2008; Morice 2006) oder einer Steroidinhalation, ggf. kombiniert mit einem Bronchodilatator für bis zu drei Monaten (Morice 2006). Ab dem Schulalter können zudem Lungenfunktions-untersuchungen, ggf. mit Laufbelastung,
Bronchospasmolyse oder Provokationstests (z.B. Metacholin) wegweisend sein.
Eine wichtige Differentialdiagnose, die klassischerweise anhand der Anamnese zu stellen ist, ist der habituelle Husten [Weinberger 2017]. Die meist männlichen Schulkinder (Median 10 Jahre, interquartile Spannbreite drei bis 16 Jahre) bieten dröhnende, teils bellende oder „hupende“ appellative Husten-Paroxysmen, die typischerweise von der Umgebung als störend empfunden werden, bei Ablenkung nachlassen und in der Regel nachts sistieren [Berman 1966; Pringsheim 2019; Wright 2018; Kravitz 2016; Weinberg 1980; Vertigan 2015; Weinberger 2016; Cohlan 1984; Lokshin 1991; Weinberger 2018].
Ebenfalls vornehmlich klinisch zu diagnostizieren ist die Pertussis, verursacht durch Bordetella pertussis, aber auch B. parapertussis, sowie pertussisähnliche Präsentationen durch Infektionen mit Respiratorisches Syncytial Virus (RSV), Humanes Metapneumovirus (HMPV), Boca-Viren oder Mykoplasmen [Harnden 2006]. Der „Keuchhusten“ zeigt bis zu drei Monate dauernde Hustenanfälle bis zum Erbrechen, die bellend und – vor allem bei Säuglingen und jüngeren Kinder n- mit Zyanoseattacken einhergehen können und – im Gegensatz zum habituellen Husten- circadian die Betroffenen quälen. Die aktuellen STIKO Impfempfehlungen sehen eine Pertussis-Grundimmunisierung im Säuglingsalter gefolgt von Auffrischimpfungen im Alter von 5-6, 9-16 Jahren sowie einmalig bei Erwachsenen und in besonderen Situationen (z.B. Schwangerschaft, Umgebungsimmunisierung, besondere Schutzbedürftigkeit) vor. Die verfügbaren azellulären Pertussisvakzine verhindern v.a. schwere Verläufe, haben auf Übertragung und Infektion nur begrenzte Effekte (Nieves & Heininger 2016).
Husten variiert je nach Ätiologie in seiner Klangqualität, Frequenz und Intensität. Als „feucht“ bezeichnen wir einen mit vermehrter Sekret-/Schleimproduktion einhergehenden produktiven Husten mit grobblasigen Rasselgeräuschen und – je nach Altersgruppe – auch Auswurf. Dem chronischen feuchten Husten können u.a. Asthma [Weinberger 2008], aspirierte Fremdkörper, die protrahierte bakterielle Bronchitis (PBB) [Kompare 2012], Mukoviszidose [O’Sullivan 2009], primäre ziliäre Dyskinesie (PCD) [Bush 2007] oder Bronchiektasie anderer Genese zugrunde liegen [Chang Lancet 2018]. Dabei kann Asthma oder Mukoviszidose in jedem Alter auftreten; die PBB ist klassischerweise eine Krankheit des Kleinkind- und Vorschulalters [Chang Chest 2012], während Kinder mit PCD schon ab dem Säuglingsalter auffallen können [Bush 2007].
Zusammen mit der chronisch eitrigen Lungenerkrankung (chronic suppurative lung disease, CSLE) bilden die erstmals 2006 als eigene Entität beschriebene Protrahierte bakterielle Bronchitis (PBB) [Chang Chest 2006] und die Bronchiektasie das ursächliche Spektrum des pädiatrischen chronisch feuchten Hustens (Abb. 1) [Chang Pediatr. Pulmonol 2008]. Die PBB ist hierbei einer der häufigsten Gründe für chronisch feuchten Husten und für schätzungsweise 40% der pädiatrisch-pneumologischen Zuweisungen (Chang Chest 2012) verantwortlich, wobei PBB und Bronchiektasie zwei Enden eines Spektrums eitriger endobronchialer Erkrankungen darstellen [Chang Pediatr. Pulmonol. 2008] und die PBB in eine Bronchiektasie übergehen kann [Wurzel 2016]. Eine retrospektive Studie an 62 Kindern mit PBB zeigte binnen durchschnittlich 7,7 Jahren Nachverfolgung bei 17,7% nach der ersten PBB Episode chronischen oder rezidivierenden Husten, 24,2% hatten eine auffällige Spirometrie und Schnittbildgebungen zeigten bei vier von neun Kindern Bronchialwandauffälligkeiten bis hin zu beginnenden Bronchiektasen (Hermann, Brinkmann et al 2025). Manche Kinder mit PBB
können eine entzündungsbedingte bronchiale Hyperreagibilität aufweisen und somit neben dem Leitsymptom ‚chronisch feuchter Husten‘ auch durch Giemen auffallen, was als Asthma fehlinterpretiert werden kann.
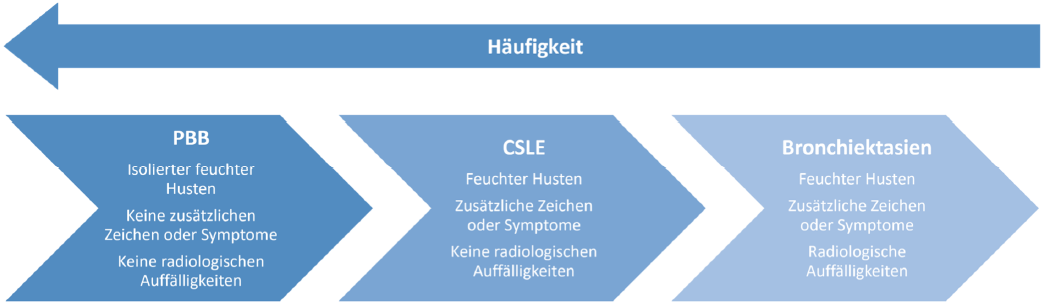
Abbildung 1. Spektrum des chronisch feuchten Hustens. PBB = protrahierte bakterielle Bronchitis; CSDL = chronisch eitrige Lungenerkrankung (chronic suppurative lung disease) Modifiziert nach Chang Pediatr. Pulmonol 2008. Manche Kinder mit PBB können eine entzündungsbedingte bronchiale
Hyperreagibilität aufweisen und somit neben dem Leitsymptom ‚chronisch feuchter Husten‘ auch durch Giemen auffallen, was als Asthma fehlinterpretiert werden kann (Schwerk 2011).
Hustensyndrom der oberen Atemwege (HSOA)
Beim postnasalen Abtropfen (Post-nasal drip, PND) drainieren Sekrete aus der Nase oder den paranasalen Sinus in den Pharynx. Wegweisend ist oft die Angabe der Patienten, „etwas tropfe in ihren Hals“ oder häufigen Räusperns, wobei letzteres auch Ausdruck einer Dyskrinie bei nicht hinreichend kontrolliertem Asthma bronchiale oder eines habituellen Hustens sein kann.
Der Befund schleimiger Sekrete im Rachen oder eines Pflastersteinreliefs der Pharynxschleimhaut sind ebenfalls für das HSOA suggestiv (Pratter 2006).
Da die pathophysiologischen Mechanismen des postnasalen Abtropfens unverändert kontrovers diskutiert werden, empfehlen die Fachgesellschaften, bei Husten im Kontext oberer Atemwegsprobleme besser vom „Husten-Syndrom der Oberen Atemwege“ (HSOA) zu sprechen (Pratter 2006), wozu auch der chronische Husten, die postinfektiös erhöhte bronchiale Reizempfindlichkeit, Rhinosinusitis und Adenoiditis zählen (Dicpinigaitis 2011). Je
nach untersuchter Altersgruppe und zugrundeliegenden Kriterien variiert der Anteil an HSOAPatienten beim chronischen Husten zwischen 3 und 38 % (Shields 2007; Marchant 2006; Asilsoy 2008). Eine Therapie mit Antihistaminika und/oder topischen Steroiden kann hilfreich sein, wobei die Evidenz niedrig ist (Yu 2015; Scadding 2008; Macedo (2009). Tabelle 1 nennt die wichtigsten Unterscheidungsmerkmale zwischen dem HSOA und der PBB.
Tabelle 1: Klinische Differentialdiagnose PBB vs. Hustensyndrom der oberen Atemwege (HSOA)
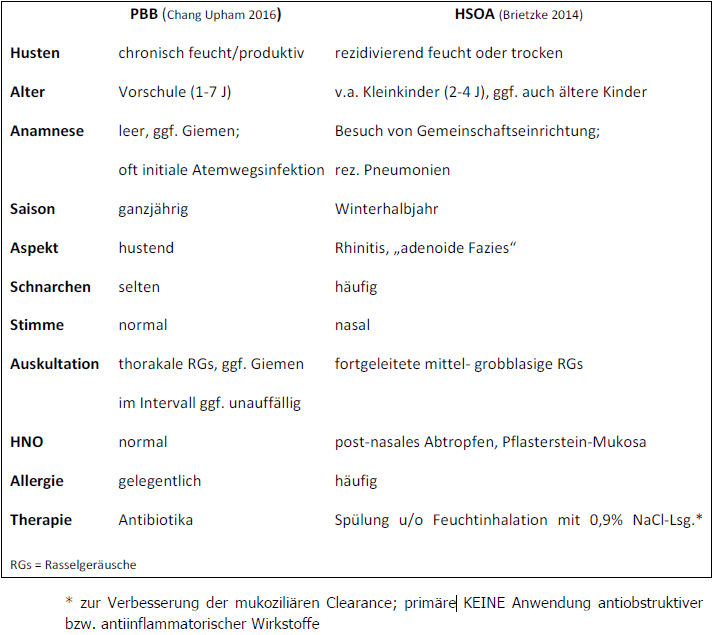
Tabelle 2: Sogenannte „rote Flaggen“ sind suggestiv für Grundkrankheiten [Chang Med J Aust 2006]:

Bei der PBB ist ohne anamnestisch-klinische „rote Flaggen“ mit Verschwinden des Hustens unter antibiotischer Therapie keine Bronchoskopie oder andere ätiologische Abklärung notwendig. Bei mehr als drei PBB-Episoden pro Jahr gilt diese als rezidivierend [Gallucci 2020]. Die Betroffenen sind typischerweise im Kleinkind- bis Vorschulalter. Es besteht eine Knabenwendigkeit sowie häufig der Besuch einer Gemeinschaftseinrichtung [Chang Ped Pul 2016; Wurzel 2014]. Labormedizinisch findet sich ein normales adaptives Immunsystem mit unauffälligen Immunglobulin-Spiegeln, Impfantikörpern und fehlenden Hinweisen auf systemische Entzündung [Kantar 2017]. Röntgen-Aufnahmen der Lunge sind meist unauffällig oder zeigen unspezifische peribronchiale Veränderungen.
Weitere Differentialdiagnosen chronischen Hustens insbesondere bei jungen Kindern sind aspirierte oder aurikuläre Fremdkörper, wobei letztere über eine Stimulation des Arnoldschen Nervs (Ramus auricularis nervi vagi) den Husten anstoßen (Molloy 2019; Smith 1963).
Bei chronischem Husten im Rahmen pneumologischer Grundkrankheiten bestehen in der Regel richtungsweisende Befunde wie Tachydyspnoe oder Hypoxämie, die weitergehende Abklärungen erfordern. Insgesamt ist – anders als bei Erwachsenen – unerklärbarer chronischer Husten bei Kindern eher eine Seltenheit, auch wenn gelegentlich neue Entitäten beschrieben werden (Spencer 2018).
4. Diagnostik
Bildgebende Befunde können ebenfalls richtungsweisend sein. Im konventionellen Thorax-Röntgen, CT oder MRT dargestellte Bronchiektasen werden bei CF, PCD, PBB oder auch bei schwerem Asthma bronchiale oder z.B. nach schweren Atemwegsinfektionen (z.B. durch Adenoviren) gefunden (Chang Lancet 2018; Eg 2017).
Tabelle 3: Wegweisende radiologische Befunde bei chronischem Husten

Falls eine Bronchoskopie mit bronchoalveolärer Lavage (BAL) erfolgt, zeigt sich bei der PBB in der Regel ein putrides, die Atemwege obliterierendes Sekret, in der BAL eine Neutrophilie mit über 10.000 Bakterien/ml (meist Haemophilus influenzae, Moraxella catarrhalis, oder Streptococcus pneumoniae (Kompare 2012]. Hier spricht man im internationalen Sprachgebrauch von einer „PBB-micro“ im Sinne einer mikrobiologisch gesicherten protrahierten bakteriellen Bronchitis. Mit klinisch gesicherter protrahierter bakterieller Bronchitis („PBB-clinical“) definiert die European Respiratory Society (ERS) eine PBB, die unter einem zweiwöchigen Zyklus mit Aminopenicillin plus Betalaktamase-Hemmer verschwindet; in Einzelfällen kann auch eine (max.) vierwöchige Behandlung notwendig sein (Kantar 2017). Eine australische randomisierte prospektive klinische Studie an 106 Kindern mit PBB verglich zwei Wochen Amoxycillin-Clavulansäure (Gruppe 1) mit vier Wochen (Gruppe 2). Am Tag 28 waren 70% aus Gruppe 12 versus 62% aus Gruppe 2 klinisch gesund (RR 0,87; n.s.); die Zeit bis zur nächsten Exazerbation war bei Gruppe 1 36 versus 150 Tage in Gruppe 2 (HR 0,47, p = 0,02) und ein Rezidiv erlitten 74% in Gruppe 1 versus 53% in Gruppe 2 (OR 0,39, n.s.). Die Autoren schlussfolgern, dass eine vierwöchige Therapie geringe Vorteile gegenüber zwei Wochen bietet und es wichtig ist, Kinder zu identifizieren, die von einer länger als zweiwöchigen antibiotischen Therapie profitieren (Rufles 2021). Entsprechend sollte die zweiwöchige Therapie im Sinne eines rationalen Antibiotikaeinsatzes favorisiert werden. Bei weiter bestehendem, nicht rückläufigem feuchtem Husten sollte eine Bronchoskopie mit BAL erfolgen. Mittels Bronchoskopie können zudem weitere Ursachen chronischen Hustens entdeckt werden wie eine Fremdkörperaspiration, Laryngotracheoösophageale Spalten oder Fisteln oder auch eine andere Fehlbildung (Tracheobronchomalazie, obliterierende lymphatische Strukturen des Pharynx, Uvula-Anomalien etc. (Wood 1990; Najada 2002; Gurgel 2008; Wallis 2019; Ghezzi 2016)).
5. Therapie des chronischen feuchten Hustens bei Kindern, insbesondere PBB
Die folgenden Empfehlungen gelten für Kinder bis 14 Jahre. Für Kinder > 14 Jahre wird auf die AWMF Leitlinie ‚Chronischer Husten‘ verwiesen (DEGAM 2021).
Typischer habitueller Husten ergibt sich aus der richtungsweisenden Anamnese. Psychotherapie mit verhaltenstherapeutischem Ansatz kann die zugrundliegende Störung erkunden und gleichsam den Betroffenen Wege aus dem sozial stigmatisierenden Husten bahnen (Cohlan 1984; Lokshin 1991; Weinberger 2018).
Asthmatische Beschwerden bessern sich in der Regel unter inhalativen Korikosteroiden und/oder p.o. Leukotrienrezeptorantagonisten (Montelukast) (Doan 1992). Chronischer Husten im Rahmen einer Pertussis stellt eine therapeutische Herausforderung dar. Antibiotika wie Makrolide oder Tetrazykline haben kaum Einfluss auf den Husten, sondern unterbrechen nur die Kontagiosität der Bordetella-Infektion (Cherry 2018). Gewisse Linderung der quälenden Reizhustenparoxysmen sind durch salinische Feuchtinhalationen, Ipratropiumbromid oder Honig beschrieben.
Antiinfektiva bei PBB
Mittel der Wahl sind fixe Kombinationen aus einem Aminopenicillin und Betalaktamase-Hemmer (z.B. Amoxicillin-Clavulansäure) aufgrund der guten Wirksamkeit gegen die häufigsten Erreger: H. influenzae, S. pneumoniae und M. catarrhalis und in Anbetracht der vor allem bei H. influenzae und M. catarrhalis verbreiteten Betalaktamasen [Gallucci 2020]. Hiermit behandelte Kinder sind nach zwei Wochen überwiegend beschwerdefrei [Donnelly 2007; Marchant 2012; Chang Chest 2016]. Manchmal sind längere Behandlungen (max. 4 Wochen) und ggf. Modifikationen nach Resistogramm (z.B. aus BAL, induziertem Sputum) notwendig.
Das US-amerikanische College of Chest Physicians (ACCP) wie auch die European Respiratory Society (ERS) empfehlen zwei Wochen antibiotische Therapie mit weiteren zwei Wochen bei ausbleibender Besserung [Chang Chest 2020; Kantar 2017], die British Thoracic Society (BTS) sogar vier bis sechs Wochen [Shields 2008]. Eine retrospektive Studie zeigte für eine sechswöchige Therapie eine geringere Rezidivwahrscheinlichkeit als nach zwei Wochen (OR 0,115; 95%CI 0,026–0,509, p = 0,019) [Gross-Hodge 2020]. Eine andere multizentrische randomisierte Studie konnte für zwei versus vier Wochen Behandlungsdauer keinen Unterschied hinsichtlich des Husten-Sistierens finden; allerdings war nach vier Wochen bei den Kindern mit Rezidiven die Zeit bis zur nächsten PBB-Episode signifikant länger (150 vs. 38 Tage) [Ruffles 2021]. Betalaktamase-stabile Antibiotika: z.B. Amoxicillin/Clavulansäure sind Mittel der Wahl bei der Therapie der PBB. Da der Langzeiteffekt einer Therapie mit Amoxicillin / Clavulansäure moderat ist, wohingegen der langanhaltende ungünstige Effekt einer antibiotischen Therapie auf das Mikrobiom wissenschaftlich gesichert ist, soll vor jeder
Antibiotikatherapie eine kritische Güterabwägung durchgeführt und die Indikation bzw. die Diagnose einer PBB kritisch geprüft werden. Bei echter Penicillinallergie kann auf Cotrimoxazol ausgewichen werden.
Langwierige und rezidivierende Formen erfordern immer differentialdiagnostische Abklärungen und entsprechende Therapien [Gallucci 2020; Li 2021; Ruffles 2021]. Bei Ansprechen auf eine adäquate Therapie gilt die Prognose der PBB als gut und Rezidive sind selten [Chang Pediatr. Pulmonol. 2016; Ruffles 2021].
6. Praktisches Vorgehen (siehe auch Abb. 2)
Abb. 2. Praktisches Vorgehen bei > 4 Wochen bestehendem, chronisch feuchtem Husten bei Kindern < 14 Jahren
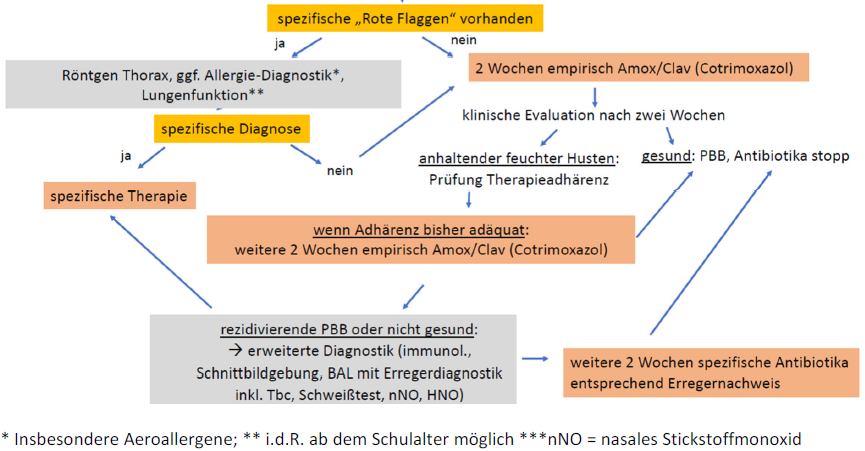
Schema A: Chronisch feuchter Husten bei Kindern < 14 J., der länger als vier Wochen
andauert
- Bei klinisch-anamnestischen „Rote Flaggen“: Röntgen Thorax und ggf. entsprechende weitere Maßnahmen (Allergie-Diagnostik, v.a. Aeroallergene, Lungenfunktion (i.d.R. ab dem Schulalter möglich)
- 2 Wochen empirisch Amoxicillin/Clavulansäure. Bei echter Penicillinallergie kann auf Cotrimoxazol ausgewichen werden.
- Klinische Evaluation nach zwei Wochen:
– gesund -> Stopp Antiinfektiva
– (noch) nicht gesund -> Korrekt durchgeführte Therapie (Dosierung & Adhärenz) überprüfen; wenn adäquat: Option zur Verlängerung der Therapie für weitere zwei Wochen:
– gesund -> Stopp Antiinfektiva
– weiter Beschwerden -> „rezidivierende PBB“ -> Schema C
Schema B (zweite Episode nach einer ausgeheilten) „hustet wieder“
- Immer vier Wochen feuchten Husten abwarten!
- Adhärenz der antiinfektiven Therapie prüfen
- Mikrobiologische Diagnostik (Sputum, bevorzugt evoziert; idealerweise molekularbiologisch mittels Multiplex PCR Panel respiratorischer Erreger, sonst auf Bakterien und empirisch respektive aktuell zirkulierende Viren)*
– Genesung keine weiteren Maßnahmen
– Weiter Beschwerden erweiterte Diagnostik inkl. immunologische Basis-Diagnostik Röntgen Thorax, HNO: “Post-nasal drip”? Adenoide? - Klinische Re-Evaluation
- erneute Antibiotikatherapie je nach Befunden / an die Erreger-Diagnostik angepasst (*Oft ist es schwierig, eine PBB von rezidivierenden (viralen) Atemwegsinfektionen abzugrenzen. Ein Beschwerdetagebuch unterstützt bei der Entscheidungsfindung und Abgrenzung, auch zur Vermeidung unnötiger weiterer Diagnostik oder wiederholten antibiotischen Therapien.)
Schema C (weiter Husten trotz vier Wochen Antibiotika)
- Erweiterte Diagnostik, inkl. immunologische Basisdiagnostik; Schnittbildgebung, Bronchoskopie mit BAL, Schweisstest, Bestimmung des Stickstoffmonoxids im nasalen Luftstrom (nNO), HNO-Konsil: „Post-nasal drip“? Adenoide?
- Klinische Re-Evaluation
- erneute Antibiotikatherapie je nach Befunden / an die Erreger-Diagnostik-angepasst
7. Fazit
Alle Kinder husten, im Rahmen akuter viraler Luftwegsinfektionen oder im Nachgang derselben. Seltener kann Husten die Folge einer viral (z.B. RSV) oder bakteriell (z.B. Pertussis) bedingten Epithelschädigung sein. Isolierter trockener Husten bei einem ansonsten gesunden Kind ist in der Regel nicht besorgniserregend. Chronisch feuchter Husten, vor allem bei Vorschulkindern, kann jedoch eine differentialdiagnostische Herausforderung darstellen. Bei PBB erfolgt in praxi die antibiotische Therapie häufig zu kurz und sollte mindestens zwei Wochen betragen (Abb. 2). Allerdings kann bei klaren Hinweisen auf ein Hustensyndrom der oberen Atemwege (HSOA) ein Therapieversuch mit salinischen Spülungen für 7-10 Tage vor
einer antibiotischen Intervention stattfinden.
Kinder mit chronischem Husten verdienen eine sorgfältige Abklärung im Hinblick auf „Rote Flaggen“. Aber genauso wichtig ist eine diagnostische und therapeutische Zurückhaltung bei der großen Mehrheit ansonsten gesunder Kinder, die einen postinfektiösen und/oder allergischen Husten haben, der v.a. auch unter dem Aspekt eines rationalen Antibiotikaeinsatzes keiner antibiotischen Intervention bedarf (Bush 2017). Nach Andrew Bush liegt die pädiatrische Kunst darin, besorgten Eltern die Diagnose eines „insgesamt gesunden Kindes“ mit auf den Weg zu geben.
8. Stellungnahme der Kommission (mit der GPP)
- Zur Diagnosestellung einer PBB müssen die relevanten ‚Roten Flaggen‘ sowie andere Ursachen für chronischen Husten anamnestisch, klinisch, durch den Verlauf und ggf. Ansprechen auf eine spezifische ex iuvantibus antibiotische Therapie ausgeschlossen werden.
- Auch wenn eine kürzere Therapiedauer bei respiratorischen Atemwegsinfektionen, z.B. bei der ambulant erworbenen Pneumonie, klar empfohlen wird, ist bei chronisch feuchtem Husten bzw. bei PBB eine mindestens 14-tägige adäquate Antibiotikatherapie indiziert.
- Die Kommission weist darauf hin, dass der kurative Langzeiteffekt einer Therapie mit Amoxicillin / Clavulansäure moderat ist, wohingegen der langanhaltende ungünstige Effekt einer antibiotischen Therapie auf das Mikrobiom wissenschaftlich gesichert ist. Entsprechend empfiehlt die Kommission, vor jeder Antibiotikatherapie eine kritische Güterabwägung durchzuführen und die Indikation bzw. die Diagnose einer PBB kritisch unter Verwendung des Algorithmus in Abb. 2 zu prüfen.
- Rezidive oder therapierefraktäre Verläufe einer PBB erfordern immer eine erweiterte Diagnostik, inklusive der Gewinnung mikrobiologischer Proben mittels BAL (falls nicht verfügbar: Sputum) vor Beginn einer antibiotischen Therapie.
- Betalaktamase-stabile Antiinfektiva: z.B. Amoxicillin/Clavulansäure sind Mittel der Wahl bei der Therapie der PBB. Bei echter Penicillinallergie kann z.B. auf Cotrimoxazol ausgewichen werden.
- Es sollte keine Kombination mit weiteren Substanzen (z.B. Makrolid Antibiotika) erfolgen.
- Zu Therapiebeginn soll auf die korrekte Dosierung und Verabreichung sowie im Verlauf auf die Therapieadhärenz geachtet werden.
- Nach zwei (jedoch spätestens nach vier Wochen) sollte ein Auslassversuch erfolgen.
- Es soll keine neue Antibiotikatherapie verordnet werden, ohne erneut vier Wochen feuchten Hustens abzuwarten.
- Die behandelnden Kinderärztinnen und Kinderärzte sollten keine blinde telefonische Anordnung erneuter Antibiotika-Zyklen oder Verlängerung einer bestehenden Therapie vornehmen. Das Kind muss vorher erneut klinisch beurteilt und ggf. mikrobiologisch evaluiert werden.
- Schließlich weist die Kommission darauf hin, dass der Prävention eine entscheidende Bedeutung zukommt. Entsprechend sollten alle Kinder mit chronisch feuchtem Husten alle STIKO empfohlenen Impfungen – inkl. gegen saisonale Influenza – erhalten.
Literatur
1. Asilsoy S, Bayram E, Agin H, Apa H, Can D, Gulle S, et al. Evaluation of chronic cough in children. Chest.
(2008) 134:1122–8
2. Berman BA: Habit cough in adolescent children. Ann Allergy. 1966; 24(1): 43–6.
3. Brietzke SE, Shin JJ, Choi S, Lee JT, Parikh SR, Pena M, et al. Clinical consensus statement: pediatric chronic
rhinosinusitis. Otolaryngol Head Neck Surg. (2014) 151:542–53
4. Britt, H.; Miller, G.C.; Bayram, C.; Henderson, J.; Valenti, L.; Harrison, C.; Pan, Y.; Charles, J.; Pollack, A.J.;
Chambers, T.; et al. A Decade of Australian General Practice Activity 2006–07 to 2015–16; Sydney
University Press: Sydney, Australia, 2016.
5. Bush A, Chodhari R, Collins N, et al.: Primary ciliary dyskinesia: Current state of the art. Arch Dis Child.
2007; 92(12): 1136–40.
6. Bush A. Persistent bacterial bronchitis: time to venture beyond the umbrella. Front Pediatr. (2017) 5:264.
7. Chang AB, Bush A, Grimwood K: Bronchiectasis in children: Diagnosis and treatment. Lancet. 2018;
392(10150): 866–79.
8. Chang AB, Glomb WB. Guidelines for evaluating chronic cough in pediatrics: ACCP evidence-based clinical
practice guidelines. Chest. (2006) 129:260S−83S
9. Chang AB, Robertson CF, van Asperen PP, et al.: A multicenter study on chronic cough in children: Burden
and etiologies based on a standardized management pathway. Chest. 2012; 142(4): 943–50.
10. Chang AB, Upham JW, Masters IB, Redding GR, Gibson PG, Marchant JM, et al. Protracted bacterial
bronchitis: the last decade and the road ahead. Pediatr Pulmonol. (2016) 51:225–42
11. Chang, A.B.; Landau, L.I.; Van Asperen, P.P.; Glasgow, N.J.; Robertson, C.F.; Marchant, J.M.; Mellis, C.M.;
Thoracic Society of Australia and New Zealand. Cough in children: Definitions and clinical evaluation.
Med. J. Aust. 2006, 184, 398–403
12. Chang, A.B.; Oppenheimer, J.J.; Irwin, R.S. Managing Chronic Cough as a Symptom in Children and
Management Algorithms: CHEST Guideline and Expert Panel Report. Chest 2020, 158, 303–329
13. Chang, A.B.; Oppenheimer, J.J.; Weinberger, M.; Grant, C.C.; Rubin, B.K.; Irwin, R.S. Etiologies of Chronic
Cough in Pediatric Cohorts: CHEST Guideline and Expert Panel Report. Chest 2017, 152, 607–617
14. Chang, A.B.; Oppenheimer, J.J.; Weinberger, M.; Rubin, B.K.; Irwin, R.S. Children with Chronic Wet or
Productive Cough—Treatment and Investigations: A Systematic Review. Chest 2016, 149, 120–142.
15. Chang, A.B.; Redding, G.J.; Everard, M.L. Chronic wet cough: Protracted bronchitis, chronic suppurative
lung disease and bronchiectasis. Pediatr. Pulmonol. 2008, 43, 519–531
16. Chang AB, Robertson CF, Van Asperen PP, Glasgow NJ, Mellis CM, Masters IB, Teoh L, Tjhung I, Morris
PS, Petsky HL, Willis C, Landau LI. A multicenter study on chronic cough in children : burden and etiologies
based on a standardized management pathway. Chest. 2012 Oct;142(4):943-950. doi: 10.1378
17. Cohlan SQ, Stone SM: The cough and the bedsheet. Pediatrics. 1984; 74(1):11–5.
18. Dicpinigaitis PV. Cough: an unmet clinical need. Br J Pharmacol. (2011) 163:116–24.
19. Doan T, Patterson R, Greenberger PA: Cough variant asthma: Usefulness of a diagnostic-therapeutic trial
with prednisone. Ann Allergy. 1992; 69(6): 505–9.
20. Donnelly, D.; Critchlow, A.; Everard, M.L. Outcomes in children treated for persistent bacterial bronchitis.
Thorax 2007, 62, 80–84.
21. Eg KP, Mirra V, Chang AB, et al.: Editorial: Chronic Suppurative Lung Disease and Bronchiectasis in
Children and Adolescents. Front Pediatr. 2017; 5: 196.
22. Gallucci, M.; Pedretti, M.; Giannetti, A.; di Palmo, E.; Bertelli, L.; Pession, A.; Ricci, G. When the Cough
Does Not Improve: A Review on Protracted Bacterial Bronchitis in Children. Front. Pediatr. 2020, 8, 433
23. Ghezzi M, Silvestri M, Sacco O, et al.: Mild tracheal compression by aberrant innominate artery and
chronic dry cough in children. Pediatr Pulmonol. 2016; 51(3): 286–94.
24. Goyal, V.; Grimwood, K.; Marchant, J.; Masters, I.B.; Chang, A.B. Does failed chronic wet cough response
to antibiotics predict bronchiectasis? Arch. Dis. Child. 2014, 99, 522–525
25. Gross-Hodge, E.; Carroll, W.D.; Rainford, N.; Gamble, C.; Gilchrist, F.J. Duration of initial antibiotic course
is associated with recurrent relapse in protracted bacterial bronchitis. Arch. Dis. Child. 2020, 105, 1111–
1113
26. Gurgel RK, Brookes JT, Weinberger MM, et al.: Chronic cough and tonsillar hypertrophy: A case series.
Pediatr Pulmonol. 2008; 43(11): 1147–1149.
27. Harnden A, Grant C, Harrison T, et al.: Whooping cough in school age children with persistent cough:
prospective cohort study in primary care. BMJ. 2006; 333(7560): 174–7.
28. Hermann J, Brückner K, Koerner-Rettberg K, Dillenhöfer S, Brinkmann F, Maier C, Heyer CM, Schlegtendal
A. Long-Term Pulmonary Sequelae 5–14 Years After Protracted Bacterial Bronchitis in Early Childhood.
Pediatric Pulmonology, 2025; 60:e71111: 1-8 https://doi.org/10.1002/ppul.7111
29. F. Holzinger, I. Bormuth, S. Gehrke-Beck, C. Heintze. Akuter und chronischer Husten. DEGAM Leitlinie:
S3 053-013 publiziert: 02/2021, gültig bis: 12/2025
30. Kantar, A.; Chang, A.B.; Shields, M.D.; Marchant, J.M.; Grimwood, K.; Grigg, J.; Priftis, K.N.; Cutrera, R.;
Midulla, F.; Brand, P.L.P.; et al. ERS statement on protracted bacterial bronchitis in children. Eur. Respir.
J. 2017, 50, 1602139
31. Kompare M, Weinberger M: Protracted bacterial bronchitis in young children: Association with airway
malacia. J Pediatr. 2012; 160: 88–92
32. Kravitz H, Gomberg RM, Burnstine RC, et al.: Psychogenic Cough Tic in Children and Adolescents. Nine
Case Histories Illustrate the Need for Re-Evaluation of This Common but Frequently Unrecognized
Problem. Clin Pediatr (Phila). 2016; 8(10): 580–3.
33. Li, Q.; Guo, Z.; Li, Y.; Zhang, G.; Tian, X.; Gu, R.; Luo, Z. Diagnosis and management of protracted bacterial
bronchitis: A survey of Chinese pediatricians. Ann. Transl. Med. 2021, 9, 46
34. Lokshin B, Lindgren S, Weinberger M, et al.: Outcome of habit cough in children treated with a brief
session of suggestion therapy. Ann Allergy. 1991; 67(6):579–82.
35. Macedo P, Saleh H, Torrego A, Arbery J, MacKay I, Durham SR, et al. Postnasal drip and chronic cough:
an open interventional study. Respir Med. (2009) 103:1700–5
36. Marchant, J.; Masters, I.B.; Champion, A.; Petsky, H.; Chang, A.B. Randomised controlled trial of
amoxycillin clavulanate in children with chronic wet cough. Thorax 2012, 67, 689–693
37. Marchant, J.M.; Masters, I.B.; Taylor, S.M.; Cox, N.C.; Seymour, G.J.; Chang, A.B. Evaluation and outcome
of young children with chronic cough. Chest 2006, 129, 1132–114
38. Molloy S, Batchelor G, McCadden L, et al.: Cough and you’ll miss it. Arch Dis Child Educ Pract Ed. 2019.
39. Morice AH, McGarvey L, PavordI: Recommendations for the management of cough in adults. Thorax.
2006; 61(Suppl 1): i1–24.
40. Morice AH, Millqvist E, Bieksiene K, Birring SS, Dicpinigaitis P, Ribas CD, Boon MH, Kantar A, Lai K,
McGarvey L, Rigau D, Satia I, Smith J, Song WJ, Tonia T, van den Berg JWK, van Manen MJG,
Zacharasiewicz A. ERS guidelines on the diagnosis and treatment of chronic cough in adults and children.
Eur Resp J 2019, 55(1): 1-31. doi:10.1183/13993003.01136-2019
41. Munyard P, Bush A. How much coughing is normal? Arch Dis Child 1996;74:531-534
42. Najada A, Weinberger M: Unusual cause of chronic cough in a four-year-old cured by uvulectomy. Pediatr
Pulmonol. 2002; 34(2): 144–6.
43. Newcombe, P.A.; Sheffield, J.K.; Petsky, H.L.; Marchant, J.M.; Willis, C.; Chang, A.B. A child chronic coughspecific
quality of life measure: Development and validation. Thorax 2016, 71, 695–700
44. Nieves DJ, Heininger U. Bordetella pertussis. Microbiol Spectr. 2016; 4(3). doi:
10.1128/microbiolspec.EI10-0008-2015. PMID: 27337481.
45. O’Grady KF, Drescher BJ, Goyal V, Phillips N, Acworth J, Marchant JM, et al. Chronic cough postacute
respiratory illness in children: a cohort study. Arch Dis Child. (2017) 102:1044–8
46. O’Sullivan BP, Freedman SD: Cystic fibrosis. Lancet. 2009; 373: 1891–904.
47. Pavord ID, Chung KF: Management of chronic cough. Lancet. 2008; 371(9621):1375–84
48. Pratter MR. Chronic upper airway cough syndrome secondary to rhinosinus diseases (previously referred
to as postnasal drip syndrome): ACCP evidence-based clinical practice guidelines. Chest. (2006)
129:63S−71S
49. Pringsheim T: Is the Term Habit Cough an Inaccurate Use of a Term? Chest. 2019; 156(6): 820–1.
50. Ruffles, T.J.C.; Goyal, V.; Marchant, J.M.; Masters, I.B.; Yerkovich, S.; Buntain, H.; Cook, A.; Schultz, A.;
Upham, J.W.; Champion, A.; et al. Duration of amoxicillin-clavulanate for protracted bacterial bronchitis
in children (DACS): A multi-centre, double blind, randomised controlled trial. Lancet Respir. Med. 2021,
9, 1121–1129
51. Ruffles, T.J.C.; Marchant, J.M.; Masters, I.B.; Yerkovich, S.T.; Wurzel, D.F.; Gibson, P.G.; Busch, G.; Baines,
K.J.; Simpson, J.L.; Smith-Vaughan, H.C.; et al. Outcomes of protracted bacterial bronchitis in children: A
5-year prospective cohort study. Respirology 2021, 26, 241–248.
52. Scadding GK, Durham SR, Mirakian R, Jones NS, Drake-Lee AB, Ryan D, et al. British Society for Allergy
and Clinical Immunology. BSACI guidelines for the management of rhinosinusitis and nasal polyposis.
Clin Exp Allergy. (2008) 38:260–75
53. Schwerk N, Brinkmann F, Soudah B, Kabesch M, Hansen G. Wheeze in preschool age is associated with
pulmonary bacterial infection and resolves after antibiotic therapy. PLoS One. 2011;6(11):e27913
54. Shields MD, Bush A, Everard ML, McKenzie SA, Primhak R. British Thoracic Society guidelines
recommendations for the assessment and management of cough in children. Thorax. (2007) 63:iii1–15
55. Shields, M.D.; Bush, A.; Everard, M.L.; McKenzie, S.; Primhak, R.; British Thoracic Society Cough Guideline,
G. BTS guidelines: Recommendations for the assessment and management of cough in children. Thorax
2008, 63 (Suppl. 3), iii1–iii15
56. Smith FM Jr: Arnold’s nerve reflex; a little known cause of cough in pediatric patients. J La State Med Soc.
1963; 115: 17–8.
57. Spencer CY, Millman J, Veiga K, et al.: Airway Autoimmune Inflammatory Response (AAIR) Syndrome: An
Asthma-Autoimune Overlap Disorder? Pediatrics. 2018; 141(3): e20170138.
58. Thompson M, Vodicka TA, Blair PS, Buckley DI, Heneghan C, Hay AD, TARGET Programme Team. Duration
of symptoms of respiratory tract infections in children: systematic review. BMJ. (2013) 347: f7027
59. Vertigan AE, Murad MH, Pringsheim T, et al.: Somatic Cough Syndrome (Previously Referred to as
Psychogenic Cough) and Tic Cough (Previously Referred to as Habit Cough) in Adults and Children: CHEST
Guideline and Expert Panel Report. Chest. 2015; 148(1): 24–31.
60. Wallis C, Alexopoulou E, Antón-Pacheco JL, et al.: ERS statement on tracheomalacia and bronchomalacia
in children. Eur Respir J. 2019; 54(3):1900382.
61. Weinberg EG: ‘Honking’: Psychogenic cough tic in children. S Afr Med J. 1980; 57(6): 198–200
62. Weinberger M, Abu-Hasan M: Asthma in the pre-school child. Kendig’s Disorders of the Respiratory Tract
in Children. 8th edition, Edited by V. Chernick, TF Boat, RW Wilmott, A Bush. Saunders Elsevier,
Philadelphia, 2012; 686–698.
63. Weinberger M, Hoegger M: The cough without a cause: Habit cough syndrome. J Allergy Clin Immunol.
2016; 137(3): 930–1.
64. Weinberger M, Lockshin B: When is cough functional, and how should it be treated? Breathe (Sheff).
2017; 13(1): 22–30.
65. Weinberger M: The habit cough: Diagnosis and treatment. Pediatr Pulmonol. 2018; 53(5): 535–7.
66. Wood RE: Localized tracheomalacia or bronchomalacia in children with intractable cough. J Pediatr.
1990; 116(3): 404–6.
67. Wright MFA, Balfour-Lynn IM: Habit-tic cough: Presentation and outcome with simple reassurance.
Pediatr Pulmonol. 2018; 53(4): 512–6.
68. Wurzel, D.F.; Marchant, J.M.; Yerkovich, S.T.; Upham, J.W.; Mackay, I.M.; Masters, I.B.; Chang, A.B.
Prospective characterization of protracted bacterial bronchitis in children. Chest 2014, 145, 1271–1278.
69. Wurzel, D.F.; Marchant, J.M.; Yerkovich, S.T.; Upham, J.W.; Petsky, H.L.; Smith-Vaughan, H.; Masters, B.;
Buntain, H.; Chang, A.B. Protracted Bacterial Bronchitis in Children: Natural History and Risk Factors for
Bronchiectasis. Chest 2016, 150, 1101–1108.
70. Yu L, Xu X, Lv H, Qiu Z. Advances in upper airway cough syndrome. Kaohsiung J Med Sci. (2015) 31:223–
8. doi: 10.1016/j.kjms.2015. 01.005


