Aktualisierte Stellungnahme (Juni 2020)
Impfungen sind heutzutage in der Regel gut verträglich. Dennoch mehren sich weltweit impfkritische Stimmen, so dass die WHO 2019 „vaccine hesitancy“ (Unschlüssigkeit zum Impfen) neu in die Liste der weltweit zehn größten Gesundheitsgefahren aufgenommen hat [1]. Viele Impfungen werden im ersten Lebensjahr durchgeführt, also dem Alter, in dem sich – unabhängig von einer vorausgegangenen Impfung – bereits viele neurologische Erkrankungen des Kindes- und Jugendalters manifestieren. Die Ätiopathogenese vieler dieser Erkrankungen ist auch heute noch nicht verstanden. Epilepsien zeigen im ersten Lebensjahr die höchste Inzidenz des Kindes- und Jugendalters [2]. Prä- oder peripartal erworbene infantile Cerebralparesen werden oft erst ab dem 2. Lebenshalbjahr, also in einem Alter nach Durchführungen der ersten Impfungen, erkannt [3]. Daher besteht häufig ein zeitlicher Zusammenhang zwischen einer Impfung und dem Auftreten neurologischer Symptome. Ein kausaler Zusammenhang zwischen Impfung und einer daraus resultierenden neurologischen Erkrankung ist jedoch äußerst unwahrscheinlich. Eine exakte,zeitnahe und ausführliche Dokumentation ist für eine bestmögliche Versorgung des Kindes sowie eine Abklärung und spätere Bewertung jedoch von großer Bedeutung [4].
Die vorliegende Aktualisierung unserer Stellungnahmen aus den Jahren 2005 und 2015 geht zunächst auf bekannte neurologische Symptome nach Impfungen und die plausiblen zeitlichen Zusammenhänge ein. Im zweiten Teil werden mögliche Zusammenhänge zwischen neurologischen Symptomen und Impfungen beschrieben. Der dritte Teil führt exemplarisch einige behauptete, aber eindeutig widerlegte Zusammenhänge auf. Der abschließende vierte Teil gibt konkrete Handlungsempfehlungen zum praktischen Vorgehen bei Auftreten ungewöhnlicher neurologischer Symptome in zeitlichem Zusammenhang mit Impfungen und macht Vorschläge zur weiteren differentialdiagnostischen Abklärung.
1. Bekannte neurologische Symptome nach Impfungen
Neurologische Symptome nach einer Impfung sind sehr viel seltener als im Rahmen der entsprechenden Infektion [5].
Fieberkrämpfe. Voraussetzung für einen kausalen Zusammenhang zwischen der Impfung und dem Auftreten der neurologischen Symptomatik ist ein plausibler zeitlicher Zusammenhang. Fieber tritt nach Impfung mit Totimpfstoffen üblicherweise in den ersten 48 Stunden, bzw. nach der Impfung mit Lebendimpfstoffen (z.B. Masern-Mumps-Röteln, Varizellen) aufgrund der erforderlichen Vermehrung der Impfviren nach 5 – 12 Tagen auf [6]. Impfungen verursachen keine Epilepsie [7], jedoch können im Rahmen von mit Impfungen assoziiertem Fieber bei entsprechender genetischer Disposition Fieberkrämpfe auftreten. Eine retrospektive Analyse von Berkovic et al. [8] konnte bei 11 von 14 Patienten mit der Diagnose einer vermeintlichen „chronischen post-vaccinalen epileptischen Encephalopathie“ nachweisen, dass die Symptomatik nicht auf die Impfung, sondern auf ein Dravet-Syndrom zurückzuführen ist, dessen Ursache Mutationen im Natrium-Kanal-Gen SCN1A sind. Bei 77 Patienten mit Dravet-Syndrom trat der erste cerebrale Anfall entweder nicht-impfassoziiert (79%) oder impfassoziiert (21%) auf, ohne dass sich der weitere Erkrankungsverlauf zwischen beiden Gruppen unterschied [9]. Damiano et al. [10] empfehlen bei allen Kindern mit prolongierten Fieberkrämpfen, die in zeitlichem Zusammenhang mit einer Impfung auftreten, eine routinemäßige SCN1A-Diagnostik.
Hypoton-hyporesponsive Episoden (HHE) sind kollapsähnliche Reaktionen bei Säuglingen und Kleinkindern, die durch plötzliches Auftreten einer erniedrigten Muskelspannung (hypoton), reduzierte Ansprechbarkeit und Reaktion auf Reize (hyporesponsiv) und bläuliche Hautfärbung oder Blässe charakterisiert sind. Die mittlere Zeit zwischen Impfung und Auftreten der Symptomatik liegt bei drei bis vier Stunden (Zeitspanne: wenige Minuten bis 48 Stunden), die Dauer beträgt zwischen sechs und 30 Minuten (bis zu einigen Tagen) [11]. HHE wurden nach Verabreichung zahlreicher Impfstoffe, am häufigsten nach den früher verwendeten Pertussisganzkeim-Kombinationsimpfstoffen beschrieben. Gesundheitliche Langzeitfolgen bei den betroffenen Patienten wurden nicht beobachtet [12]. Die Ätiologie der HHE ist bisher nicht geklärt.
Das vereinzelte Auftreten Vakzine-assoziierter paralytischer Poliomyelitis (VAPP) nach oraler Polio-Lebendimpfung führte zum Wechsel hin zum intramuskulär zu verabreichenden Polio-Totimpfstoff und damit zur Eliminierung dieser Impfnebenwirkung [13].
2. Mögliche Zusammenhänge zwischen Impfungen und neurologischen Symptomen
Hinweise auf einen kausalen Zusammenhang zwischen einer Impfung und dem nachfolgenden Auftreten einer neurologischen Erkrankung finden sich nur vereinzelt. In Finnland wurde 2010 ein Anstieg der Inzidenz der Narkolepsie bei Kindern und Jugendlichen unter 17 Jahren im Vergleich zu den Vorjahren um das 17-fache beobachtet und dem pandemischen Influenza H1N1-Impfstoff Pandemrix® zugeschrieben [14]. Ähnliche Beobachtungen wurden in Norwegen [15], Schweden [16, 17], England [18] und Frankreich [19] gemacht. Die Zusammenhänge sind bisher nicht vollständig verstanden [20, 21, 22] und eine Kausalität nicht gesichert [23]. Hinweise auf eine Assoziation zwischen der saisonalen Influenza-Impfung und dem Auftreten einer Narkolepsie finden sich nicht [24].
Nicht eindeutig sind die Daten für das Auftreten eines Guillain-Barré Syndroms (GBS) nach Influenza-Impfung. Eine US-amerikanische Metaanalyse beschrieb eine signifikante Zunahme der GBS-Inzidenz (relatives Risiko 2.35, 95% CI 1.42-4.01) nach monovalenter Influenza A (H1N1) Impfung [25]. Im Gegensatz hierzu wurde in einer multinationalen europäischen Studie für die Saison 2009 [26] und in einer US-amerikanischen Studie für die Saison 2012-2013 [27] jeweils keine Assoziation zwischen Influenza-Impfung und Auftreten eines GBS gefunden. Bei englischen Kindern und Jugendlichen bis 16 Jahre fand sich ebenso kein signifikant erhöhtes Risiko für das Auftreten eines GBS im Rahmen der pandemischen Influenza-Impfung 2009 [28]. Die US-amerikanischen Centers for Disease Control and Prevention beurteilen die Daten über eine mögliche Assoziation zwischen GBS and saisonaler Influenza-Impfung als inkonsistent [29].
Zusammenfassend gibt es entsprechend zurzeit keinen gesicherten Anhalt für das Auftreten chronischer neurologischer Erkrankungen in Folge von in Deutschland allgemein empfohlenen Impfungen.
3. Eindeutig widerlegte Zusammenhänge zwischen Impfungen und neurologischen Erkrankungen
Der immer wieder diskutierte Verdacht, Impfungen könnten neurologische Erkrankungen wie z.B. Autismus verursachen (MMR-Impfung) oder Opticusneuritis bzw. Multiple Sklerose auslösen (Hepatitis B-Impfung), wurde durch klinische Studien zweifelsfrei widerlegt [30, 31, 32, 33, 34]
4. Praktisches Vorgehen
Wenn in einem zeitlichen Zusammenhang mit Impfungen ungewöhnliche, unter Punkt 1 und Punkt 2 nicht genannte neurologische Symptome auftreten, ist eine umfangreiche Abklärung notwendig. Dies dient dem Zweck eine zugrunde liegende, eventuell behandelbare Krankheit nachzuweisen und damit einen kausalen Zusammenhang zur Impfung auszuschließen. Dazu sind eine ausführliche Anamnese und Diagnostik, sowie eine exakte und zeitnahe Dokumentation der Impfung und des klinischen Verlaufes sowie die Sicherung von Patientenproben notwendig.
Die Brighton Collaboration (www.brightoncollaboration.org) hat für zahlreiche in Zusammenhang mit Impfungen auftretende neurologische Symptome Falldefinitionen sowie Empfehlungen zur Datenerhebung und Auswertung erarbeitet, so z.B. für cerebrale Anfälle [35], HHE [36] und Narkolepsie [37].
Treten bei einem Kind oder Jugendlichen nach einer Impfung neurologische Symptome auf, erfolgt die Erstdiagnostik in der Regel durch den impfenden Arzt oder die nächstgelegene Klinik für Kinder und Jugendliche. Essentiell ist eine sehr sorgfältige Anamnese und gründliche Untersuchung des Patienten zum Zeitpunkt des Auftretens der neurologischen Symptomatik und im weiteren Verlauf. Eine ausführliche und detailreiche Dokumentation von Anamnese und Befunden hilft dabei, einen möglichen Zusammenhang zu einer Impfung auch zu späterer Zeit ggfs. erneut zu prüfen.
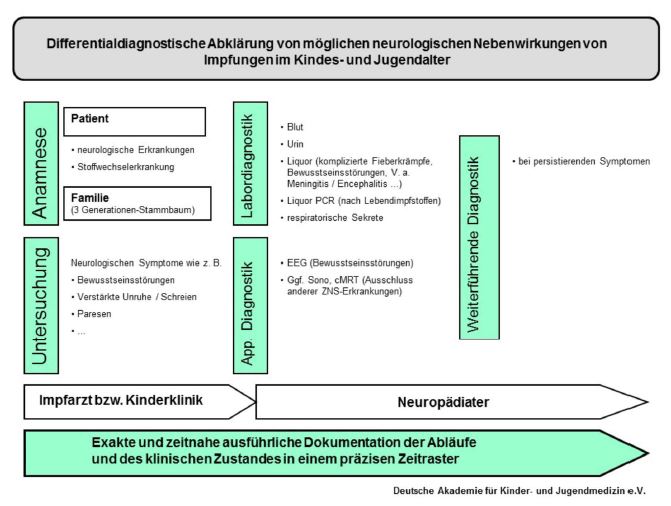
Das folgende Vorgehen wird vorgeschlagen (Abb. 1):
a. Anamnese
Von besonderer Bedeutung ist eine exakte und ausführliche Dokumentation der Abläufe und des klinischen Zustandes in einem präzisen Zeitraster. Die Durchführung der Impfung ist einschließlich Chargen-Nummer des/der verabreichten Impfstoffs/Impfstoffe anhand des Impfausweises zu dokumentieren. Die Anamnese ist insbesondere bezüglich Hinweisen auf neurologische Erkrankungen (z.B. cerebrale Anfälle), Stoffwechselkrankheiten und Hinweise auf gehäufte bzw. ungewöhnliche Infektionskrankheiten beim Patienten und der Familie zu erheben. Hier ist ein Stammbaum über 3 Generationen unter Einschluss totgeborener und verstorbener Familienmitglieder zu erstellen.
b. Untersuchung
Es ist eine ausführliche körperliche Untersuchung mit besonderer Berücksichtigung des neurologischen Status durchzuführen. Lassen sich bei der Untersuchung neurologische Symptome nachweisen, die in zeitlichem Zusammenhang mit der Impfung auftraten, sollte der Untersucher eine weiterführende Untersuchung durch einen Neuropädiater veranlassen.
c. Labordiagnostik (siehe auch Tabelle 1)
Für weiterführende Laboruntersuchungen sollten Blut, Urin, Stuhl und respiratorische Sekrete z.B. für virologische und metabolische Diagnostik asserviert und untersucht werden. Die Indikation zur Liquoruntersuchung zum Nachweis entzündlicher und metabolischer Erkrankungen sollten großzügig gestellt werden. Die Liquordiagnostik sollte umfassen: Untersuchung von Zellzahl mit Differenzierung, Gesamteiweiß, Liquorzucker/Blutzucker-Quotient, Laktat, intrathekale Immunglobulinsynthese mit gleichzeitiger Serumbestimmung und Bezug auf die Blut-Liquor-Schrankenfunktion (Reiber-Schema), oligoklonales IgG, bakteriologische Kulturen und bakteriologisch-virale Multiplex-PCR-Diagnostik, ggf. Autoantikörper (z.B. N-Methyl-D-Aspartat (NMDA)-Rezeptor-Antikörper).
Bei febrilen cerebralen Anfällen, auch im Säuglings- und Kleinkindesalter, muss an das Vorliegen von Virus-Encephalitiden gedacht werden. Zum Beispiel können Infektionen mit Parechoviren keine oder nur eine geringgradige Liquor-Pleozytose aufweisen und sind nur durch eine PCR-Diagnostik im Liquor und/oder Stuhl/respiratorische Sekrete zu diagnostizieren [38].
Nach Impfungen mit Lebendimpfstoffen sollte zusätzlich ein direkter Erregernachweis im Liquor zur Unterscheidung zwischen Impf- und Wildtyp-Virus in Absprache mit dem jeweiligen nationalen Referenzzentrum des Robert Koch-Instituts (www.rki.de) veranlasst werden.
Bei klinischem Verdacht auf das Vorliegen einer Stoffwechselerkrankung sollten bereits bei der Erstuntersuchung des Patienten Serum, EDTA-Plasma, Trockenblutkarte, Urin und ggf. Liquor zur Stoffwechseldiagnostik gewonnen werden, da z.B. Organoazidurien und Fettsäureoxidationsstörungen am besten zum Zeitpunkt der klinischen Symptomatik nachweisbar sind. Untersuchungen im symptomfreien Intervall können unauffällig sein.
Bei einer in zeitlichem Zusammenhang mit Impfungen auftretenden neurologischen Symptomatik sind zusätzlich Serum-, EDTA-Plasma-, Liquor- und Urinproben für eventuelle spätere Untersuchungen bei -20oC zu asservieren. Prinzipiell sollte auch bedacht werden EDTA-Blut ggf. für spätere genetische Diagnostik zu asservieren
d. Apparative Diagnostik
Insbesondere bei allen Patienten mit Bewusstseinsstörung ist die Ableitung eines EEG mit der Frage nach Hinweisen auf Encephalitis, einen bioelektrischen Status oder postkonvulsive Veränderungen indiziert. In Abhängigkeit der klinischen Symptomatik ist eine cerebrale Bildgebung (Sonographie, MRT mit Kontrastmittel, Diffusionswichtungen und Angiosequenz) durchzuführen. Bei Verdacht auf eine Neuritis oder eine neuromuskuläre Erkrankung ist die Nervenleitgeschwindigkeit zu bestimmen.
e. Weiterführende Diagnostik
Bei persistierenden neurologischen Symptomen sollte eine erweiterte neuropädiatrische Abklärung durchgeführt werden. Bei Verdacht auf Störungen des auditiven, visuellen oder zentralen somatosensiblen Systems sollten evozierte Potentiale abgeleitet werden. Weiterführende molekulargenetische Untersuchungen (Panel- und Exomdiagnostik im Blut) haben die Durchführung von Gewebsbiospien (z.B. Haut, Muskel, Leber) weitestgehend abgelöst. Tabelle 1 fasst mögliche Differentialdiagnosen zugrunde liegender neurologischer Erkrankungen und die zur Abklärung durchzuführende Diagnostik zusammen. Eine exakte Diagnose ist die Voraussetzung für eine gezielte Behandlung und Prognosestellung.
f. Meldepflicht
Unabhängig vom Verdacht eines „Impfschadens“ müssen unerwünschte Arzneimittelwirkungen (einschließlich Impfstoffen) in Deutschland der Zulassungsbehörde (Paul-Ehrlich-Institut) direkt und an das örtliche Gesundheitsamt und der Arzneimittelkommission der Ärzteschaft gemeldet werden. Die Rechtsgrundlagen für dieses Meldewesen finden sich im Infektionsschutzgesetz, §6: „der Verdacht einer über das übliche Ausmaß einer Impfreaktion hinausgehenden gesundheitlichen Schädigung“ ist namentlich zu melden.
Meldebögen sind im Internet abrufbar und können dort auch direkt online ausgefüllt werden: https://www.pei.de/SharedDocs/Downloads/DE/arzneimittelsicherheit/pharmakovigilanz/ifsg-meldebogen-verdacht-impfkomplikation.pdf, bzw. www.akdae.de/Arzneimittelsicherheit/UAW-Meldung/index.html
Abb. 1: Vorgehensweise zur differentialdiagnostischen Abklärung von in zeitlichem Zusammenhang mit Impfungen auftretenden neurologischen Symptome im Kindes- und Jugendalter
|
Erkrankung |
Diagnostik |
|
Cerebrale Fehlbildungen z.B. Gyrationsstörungen |
Schädelsonographie, cMRT, EEG ggf. Panel/Exom-Diagnostik) |
|
Phakomatosen z.B. Tuberöse Sklerose |
Hautinspektion (Wood-Licht) cMRT, Herz-, Nieren-Sonographie, Augenarzt; ggf. TSC1-, TSC2-Molekulargenetik |
|
Neurometabolische Erkrankungen
Urin:
Blut:
Liqor: |
cMRT, Sono-Abdomen Selektives Urinscreening auf angeborene BB mit vakuolisierten Lymphozyten, Zellen, Eiweiß, Glukose, Laktat, AminosäKlinisch nicht sicher uren, |
|
Genetische Syndrome z.B. Rett-Syndrom Angelmann-Syndrom Prader-Willi-Syndrom Fragiles X-Syndrom |
MECP2- und ggf. CDKL5- Molekulargenetik Molekulargenetik Molekulargenetik FRAX-Molekulargenetik |
|
Klinisch nicht sicher klassifizierbare Retardierungs-Syndrome |
Array-CGH, Panel/Exom-Diagnostik |
|
Epilepsien |
EEG, Schlaf-EEG, Video-Langzeit-EEG, cMRT, Familienanamnese |
|
Bei V.a. genetische Epilepsien z.B.: Dravet-Syndrom Pyridoxin-abhängige Epilepsie Glukosetransporter Defekt Epileptische Encephalopathien |
SCN1A-Molekulargenetik/Panel-Diagnostik Pipecolinsäure im Plasma Liquor-Serum-Glukose-Quotient, Panel/Exom-Diagnostik |
|
Spinale Muskelatrophie |
Muskel-Sonographie, SMN1-Genetik |
|
Hereditäre Neuropathien |
Nervenleitgeschwindigkeit (motorisch und sensibel) Molekulargenetik (PMP22, Panel/Exom) |
|
Myopathie/Myositis |
Kreatininkinase-Aktivität, Virologie HMG-CoA-Reduktase-Antikörper, α-1,4-Glucosidase (M.Pompe) Muskel-Sonographie/MRT Panel/Exom-Diagnostik ggf. Muskelbiopsie |
|
Myasthenia gravis Kongenitale myasthene Syndrome |
Acetylcholin-Antikörper Kongenitale myasthene Syndrome Tensillon-Test Molekulargenetik (Panel-Diagnostik) |
|
Pränatale Infektionen |
mütterliche Anamnese (Mutterpass, STORCH- Erkrankungen erfragen) STORCH-Serologie (incl. VZV), ggf. CMVPCR aus Neugeborenen-Screening-Karte, ggf. Liquor, Augenhintergrund, Schädelsonographie, cMRT |
|
Entzündliche ZNS-Erkrankungen Meningoencephalitis (viral, bakteriell) |
Liquor: Zellen, Eiweiß, Glukose, Laktat, bakteriolog. Kultur, Multiplex-PCR (Bakterien/Viren) neurotrope Viren (z.B. HSV, VZV, FSME, Picornaviren: Enteroviren, Parechoviren…), Borrelien-Antikörper, intrathekale Immunglobulin-Synthese oligoklonales IgG Stuhl: Picornaviren: Enteroviren, Parechoviren Respirator. Sekrete: z. B. Influenzaviren, Parechoviren, Mykoplasmen, Bordetella spp |
|
Autoimmun-Encephalitiden |
Liquor: siehe Meningoencephalitis zusätzlich: Autoantikörper-Panel (incl. NMDA-Rezeptor-Antikörper) |
|
Multiple Sklerose, ADEM |
Liquor: siehe Meningoencephalitis zusätzlich: MRZ-Reaktion |
|
Guillain-Barré-Syndrom |
Liquor: siehe Meningoencephalitis Nervenleitgeschwindigkeit |
|
Opsoklonus-Myoklonus-Ataxie Syndrom |
Spontanurin: Homovanilinsäure und Vanillinmandelsäure Abdomen-Sono, MRT Abdomen u. spinales MRT |
|
Vaskulopathien (Blutungen, Thrombosen) |
Gerinnungsdiagnostik, cMRT mit Angiosequenz |
|
ZNS-Tumoren |
cMRT, spinales MRT |
|
Residualsyndrome (prä-, peripartal) = Infantile Cerebralparesen |
Schwangerschafts- und Geburtsanamnese, Schädelsonographie, cMRT, EEG |
|
Intoxikationen |
Toxikologie |
Tab 1.: Auswahl sich in zeitlichem Zusammenhang mit Impfungen möglicherweise
manifestierender neurologischer Erkrankungen und der durchzuführenden Diagnostik
Abkürzungen: cMRT =cerebrale Magnetresonanztomographie, EEG = Elektroencephalographie, MRZ= Masern-Röteln-Zoster,
NMDA= N-Methyl-D-Aspartat
Hier die Stellungnahme als PDF.
Literatur
- WHO – World Health Organization (2019): Ten threats to global health in 2019. www.who.int/emergencies/ten-threats-to-global-health-in-2019 (Zugriffs-Datum 03.06.2020)
- Camfield P, Camfield C (2015): Incidence, prevalence and aetiology of seizures and epilepsy in children. Epileptic Disord 17(2):117-23
- Panteliadis CP, Hagel C, Karch D, Heinemann K (2015): Cerebral Palsy: A Lifelong Challenge Asks for Early Intervention. Open Neurol J9:45-52
- Lateef TM, Johann-Liang R, Kaulas H, Hasan R, Williams K, Caserta V, Nelson KB (2015): Seizures, encephalopathy, and vaccines: experience in the National Vaccine Injury Compensation Program. J Pediatr 166:576-81
- Miravalle A, Biller J, Schnitzler E, Bonwit A (2010): Neurological complications following vaccinations. Neurol Res 32(3):285-92
- Knuf M, Habermehl P, Zepp F, Mannhardt W, Kuttnig M, Muttonen P, Prieler A, Maurer H, Bisanz H, Tornieporth N, Descamps D, Willems P (2006): Immunogenicity and safety of two doses of tetravalent measles-mumps-rubella-varicella vaccine in healthy children. Pediatr Infect Dis J 25:12-8
- Vestergaard M, Hviid A, Madsen KM, Wohlfahrt J, Thorsen P, Schendel D, Melbye M, Olsen J (2004): MMR vaccination and febrile seizures: evaluation of susceptible subgroups and long-term prognosis. JAMA 292: 351-357
- Berkovic SF, Harkin L, McMahon JM, Pelekanos JT, Zuberi SM, Wirrell EC, Gill DS, Iona X, Mulley JC, Scheffer IE (2006): De-novo mutations of the sodium channel gene SCN1A in alleged vaccine encephalopathy: a retrospective study. Lancet Neurology 5:488-92.
- Verbeek NE, van der Maas NA, Sonsma AC, Ippel E, Vermeer-de Bondt PE, Hagebeuk E, Jansen FE, Geesink HH, Braun KP, de Louw A, Augustijn PB, Neuteboom RF, Schieving JH, Stroink H, Vermeulen RJ, Nicolai J, Brouwer OF, van Kempen M, de Kovel CG, Kemmeren JM, Koeleman BP, Knoers NV, Lindhout D, Gunning WB, Brilstra EH (2015): Effect of vaccinations on seizure risk and disease course in Dravet syndrome. Neurology 18:596-603
- Damiano JA, Deng L, Li W, Burgess R, Schneider AL, Crawford NW, Buttery J, Gold M, Richmond P, Macartney KK, Hildebrand MS, Scheffer IE, Wood N, Berkovic SF (2020): SCN1A Variants in vaccine-related febrile seizures: A prospective study. Ann Neurol 87:281-288
- Weißer K, Barth I, Keller-Stanislawski B (2009): Sicherheit von Impfstoffen. Bundesgesundheitsb 52:1053–1064
- Vigo A, Costagliola G, Ferrero E, Noce S (2017): Hypotonic-hyporesponsive episodes after administration of hexavalent DTP-based combination vaccine: A description of 12 cases. Hum Vaccin Immunother 13:1-4
- Alexander LN, Seward JF, Santibanez TA, Pallansch MA, Kew OM, Prevots DR, Strebel PM, Cono J, Wharton M, Orenstein WA, Sutter RW (2004): Vaccine policy changes and epidemiology of poliomyelitis in the United States. JAMA 292:1696-701
- Partinen M, Saarenpää-Heikkilä O, Ilveskoski I, Hublin C, Linna M, Olsén P, Nokelainen P, Alén R, Wallden T, Espo M, Rusanen H, Olme J, Sätilä H, Arikka H, Kaipainen P, Julkunen I, Kirjavainen T (2012): Increased incidence and clinical picture of childhood narcolepsy following the 2009 H1N1 pandemic vaccination campaign in Finland. PLoS One 7(3):e33723
- Heier MS, Gautvik KM, Wannag E, Bronder KH, Midtlyng E, Kamaleri Y, Storsaeter J (2013): Incidence of narcolepsy in Norwegian children and adolescents after vaccination against H1N1 influenza A. Sleep Med 14:867-71
- Szakács A, Darin N, Hallböök T (2013): Increased childhood incidence of narcolepsy in western Sweden after H1N1 influenza vaccination. Neurology 80:1315-21
- Feltelius N, Persson I, Ahlqvist-Rastad J, Andersson M, Arnheim-Dahlström L, Bergman P, Granath F, Adori C, Hökfelt T, Kühlmann-Berenzon S, Liljeström P, Maeurer M, Olsson T, Örtqvist Å, Partinen M, Salmonson T, Zethelius B (2015): A coordinated cross-disciplinary research initiative to address an increased incidence of narcolepsy following the 2009-2010 Pandemrix vaccination programme in Sweden. J Intern Med 278:335-53
- Miller E, Andrews N, Stellitano L, Stowe J, Winstone AM, Shneerson J, Verity C (2013): Risk of narcolepsy in children and young people receiving AS03 adjuvanted pandemic A/H1N1 2009 influenza vaccine: retrospective analysis. BMJ 346:f794
- Dauvilliers Y, Arnulf I, Lecendreux M, Monaca Charley C, Franco P, Drouot X, d’Ortho MP, Launois S, Lignot S, Bourgin P, Nogues B, Rey M, Bayard S, Scholz S, Lavault S, Tubert-Bitter P, Saussier C, Pariente A; Narcoflu-VF study group (2013): Increased risk of narcolepsy in children and adults after pandemic H1N1 vaccination in France. Brain 136:2486-96
- Verstraeten T, Cohet C, Dos Santos G, Ferreira GL, Bollaerts K, Bauchau V, Shinde V (2015): Pandemrix™ and narcolepsy: A critical appraisal of the observational studies. Hum Vaccin Immunotherp 17:1-7
- Lind A, Eriksson D, Akel O, Ramelius A, Palm L, Lernmark Å, Kämpe O, Elding Larsson H, Landegren N (2020): Screening for autoantibody targets in post-vaccination narcolepsy using proteome arrays. Scand J Immunol 91(4):e12864
- Stowe J, Andrews N, Miller E (2020): Do Vaccines Trigger Neurological Diseases? Epidemiological Evaluation of Vaccination and Neurological Diseases Using Examples of Multiple Sclerosis, Guillain-Barré Syndrome and Narcolepsy. CNS Drugs 34:1-8
- Weibel D, Sturkenboom M, Black S, de Ridder M, Dodd C, Bonhoeffer J, Vanrolleghem A, van der Maas N, Lammers GJ, Overeem S, Gentile A, Giglio N, Castellano V, Kwong JC, Murray BJ, Cauch-Dudek K, Juhasz D, Campitelli M, Datta AN, Kallweit U, Huang WT, Huang YS, Hsu CY, Chen HC, Giner-Soriano M, Morros R, Gaig C, Tió E, Perez-Vilar S, Diez-Domingo J, Puertas FJ, Svenson LW, Mahmud SM, Carleton B, Naus M, Arnheim-Dahlström L, Pedersen L, DeStefano F, Shimabukuro TT (2009): Narcolepsy and adjuvanted pandemic influenza A (H1N1) 2009 vaccines -Multi-country assessment. Vaccine 36:6202-6211
- Jefferson T, Rivetti A, Di Pietrantonj C, Demicheli V (2018): Vaccines for preventing influenza in healthy children. Cochrane Database Syst Rev. 2018 Feb 1;2
- Salmon DA, Proschan M, Forshee R, Gargiullo P, Bleser W, Burwen DR, Cunningham F, Garman P, Greene SK, Lee GM, Vellozzi C, Yih WK, Gellin B, Lurie N; H1N1 GBS Meta-Analysis Working Group (2013): Association between Guillain-Barre syndrome and influenza A (H1N1) 2009 monovalent inactivated vaccines in the USA: a meta-analysis. Lancet 381:1461-8
- Romio S, Weibel D, Dieleman JP, Olberg HK, de Vries CS, Sammon C, Andrews N, Svanström H, Mølgaard-Nielsen D, Hviid A, Lapeyre-Mestre M, Sommet A, Saussier C, Castot A, Heijbel H, Arnheim-Dahlström L, Sparen P, Mosseveld M, Schuemie M, van der Maas N, Jacobs BC, Leino T, Kilpi T, Storsaeter J, Johansen K, Kramarz P, Bonhoeffer J, Sturkenboom MC (2014): Guillain-Barré syndrome and adjuvanted pandemic influenza A (H1N1) 2009 vaccines: a multinational self-controlled case series in Europe. PLoS One. 2014 9:e82222
- Kawai AT, Li L, Kulldorff M, Vellozzi C, Weintraub E, Baxter R, Belongia EA, Daley MF, Jacobsen SJ, Naleway A, Nordin JD, Lee GM (2014): Absence of associations between influenza vaccines and increased risks of seizures, Guillain-Barré syndrome, encephalitis, or anaphylaxis in the 2012-2013 season. Pharmacoepidemiol Drug Saf 23:548-53
- Verity C, Stellitano L, Winstone AM, Stowe J, Andrews N, Miller E (2014): Pandemic A/H1N1 influenza vaccination, preseding infections and clinical findings in Uk children Guillain-Barre syndrome. Arch Dis Child 99:532-8
- Centers for Disease Control and Prevention. Guillain-Barré syndrome and Flu Vaccine. https://www.cdc.gov/flu/prevent/guillainbarre.htm (Zugriffs-Datum 03.06.20)
- Taylor LE, Swerdfeger AL, Eslick GD (2014): Vaccines are not associated with autism: an evidence-based meta-analysis of case-control and cohort studies. Vaccine 32:3623-9
- Hviid A, Hansen JV, Frisch M, Melbye M (2019): Measles, Mumps, Rubella Vaccination and Autism: A Nationwide Cohort Study. Ann Intern Med. 2019 Apr 16;170(8):513-520
- Maglione MA, Das L, Raaen L, Smith A, Chari R, Newberry S, Shanman R, Perry T, Goetz MB, Gidengil C (2014): Safety of vaccines used for routine immunization of US children: A systematic review. Pediatrics 134:325-337
- Farez MF, Correale J (2011): Immunizations and risk of multiple sclerosis: systematic review and meta-analysis. J Neurol 258:1197-206
- DeStefano F, Verstraeten T, Jackson LA, Okoro CA, Benson P, Black SB, Shinefield HR, Mullooly JP, Likosky W, Chen RT; Vaccine Safety Datalink Research Group, National Immunization Program, Centers for Disease Control and Prevention (2003): Vaccinations and risk of central nervous system demyelinating diseases in adults. Arch Neurol 60:504-9
- Bonhoeffer J, Menkes J, Gold MS, de Souza-Brito G, Fisher MC, Halsey N, Vermeer P; Brighton Collaboration Seizure Working Group (2004): Generalized convulsive seizure as an adverse event following immunization: case definition and guidelines for data collection, analysis, and presentation. Vaccine 22:557-62
- Buettcher M, Heininger U, Braun M, Bonhoeffer J, Halperin S, Heijbel H, de Menezes Martins R, Vermeer-de Bondt P; Brighton Collaboration HHE Working Group (2007): Hypotonic-hyporesponsive episode (HHE) as an adverse event following immunization in early childhood: case definition and guidelines for data collection, analysis, and presentation Vaccine 25:5875-81
- Poli F, Overeem S, Lammers GJ, Plazzi G, Lecendreux M, Bassetti CL, Dauvilliers Y, Keene D, Khatami R, Li Y, Mayer G, Nohynek H, Pahud B, Paiva T, Partinen M, Scammell TE, Shimabukuro T, Sturkenboom M, van Dinther K, Wiznitzer M, Bonhoeffer J (2013): Narcolepsy as an adverse event following immunization: case definition and guidelines for data collection, analysis and presentation. Vaccin 31:994-1007
Harvala H, Wolthers KC, Simmonds P (2010): Parechoviruses in children: understanding a new infection. Curr Opin Infect Dis 23:224-30
Kommission für Infektionskrankheiten und Impffragen der Deutschen Akademie für Kinder- und Jugendmedizin
Prof. Dr. med. G. Ch. Korenke (Oldenburg, federführend), Prof. Dr. med. U. Heininger (Basel, Kommissionssprecher), PD Dr. U. von Both (München), Dr. Herbert Grundhewer (Berlin), Dr. A Iseke (Bochum), Prof. Dr. med. M. Knuf (Wiesbaden), Prof. Dr. A. Müller (Bonn)
Korrespondenzadresse:
Prof. Dr. med. Hans-Iko Huppertz, Generalsekretär,
Deutsche Akademie für Kinder- und Jugendmedizin (DAKJ) e. V.
Chausseestr. 128/129; 10115 Berlin; Tel.: 030.4000588-0; Fax.: 030.4000588-88
e-Mail: kontakt@dakj.de; Internet: www.dakj.de